| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》考点巩固(2017年最新版)(六)
参考答案:D 本题解析:A项等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,反应后溶液溶质为(NH4)2SO4、Na2SO4等物质的量混合液,NH4+水解溶液呈酸性,故溶液中离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),A项正确;B项25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),则溶液中c(H+)=c(OH-)=10-7mol/L,故NH3·H2O的电离常数 本题难度:困难 2、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
(1)不考虑其它组的实验结果,单从甲组情况分析,若a 7(填>、<或=),则HA为弱酸。 (2)在乙组中混合溶液中离子浓度 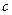 (A-)与 (A-)与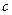 (Na+)的大小关系是 。 (Na+)的大小关系是 。A.前者大 B.后者大 C.二者相等 D.无法判断 |
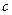
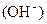 = mol·L-1。
= mol·L-1。 参考答案:(每小题3分)(1)> (2)C (3)弱 Na+>A->OH->H+ (4)10-5
本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。
(3)丙组中HA酸过量,但溶液显碱性,所以HA是弱酸。
(4)因溶液pH=9,c(OH-)=10-6mol/L,全部来源于水的电离。
本题难度:一般
3、选择题 在10mL?pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是
[? ]
A.?0.01mol/L?CH3COOH?
B.?0.01mol/L?HNO3
C.?pH=2的H2SO4溶液?
D.?pH=2的CH3COOH溶液
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.甲基橙的变色PH范围在4.4~6.2之间。
B.保护海轮外壳以及石油管道通常是用牺牲阳极的阴极保护法。
C.电离常数可以表示弱酸的相对强弱,电离常数越小,弱酸的酸性越强。
D.弱电解质的电离是一个放热过程。
参考答案:B
本题解析:A:甲基橙的变色PH范围在3.1~4.4之间
B:正确
C:一般来讲,电离常数越大,弱酸的酸性越强
D:弱电解质的电离是一个吸热过程
答案为B
本题难度:一般
5、选择题 根据要求填空:
(1)在0.1mol/L的CH3COOH溶液中,若加入少量的蒸馏水,溶液的pH ;若加入少量的纯醋酸,溶液中的c(CH3COO—) ;若加入少量的NaOH固体,溶液中的c(H+) ;若加入少量的CH3COONa固体,溶液中的c(OH—) 。(以上均用“增大”、“减小”或“不变”填空)
(2)在以KOH为电解质溶液的氢氧燃料电池中,电池工作时其负极的电极反应式为 正极的电极反应式为 。
参考答案:(1)增大;增大;减小;增大。(2)2H2-4e—+4OH—=4H2O , O2+4e—+2H2O=4OH—
本题解析:(1)对于0.1mol/L的稀CH3COOH溶液中,若加入少量的蒸馏水,电离平衡CH3COOH  CH3COO-+H+.向正反应方向移动,使溶液的H+浓度增大,但水对离子的稀释作用大于平衡正向移动使离子浓度增大的趋势,总的来说C(H+)减小,所以溶液的pH增大。若加入少量的纯醋酸,由于C(CH3COOH)增大,平衡正向移动,使C(CH3COOH)减小,溶液中的c(CH3COO—)增大。若加入少量的NaOH固体,由于发生反应:H++OH-=H2O消耗了溶液中的H+,使c(H+)减小,平衡正向移动使c(H+)又有所增加,但消耗的浓度大于平衡增加的浓度,总的来说溶液中c(H+)减小。若加入少量的CH3COONa固体,溶液中的c(CH3COO—)增大,平衡逆向移动,溶液中c(H+)减小,c(OH—)增大。(2)以KOH为电解质溶液的氢氧燃料电池中,通入H2的电极为负极,电池工作时其负极的电极反应式为2H2-4e—+4OH—=4H2O,通入O2的电极为正极,正极的电极反应式为O2+4e—+2H2O=4OH—。总反应式为2H2+O2=2H2O。
CH3COO-+H+.向正反应方向移动,使溶液的H+浓度增大,但水对离子的稀释作用大于平衡正向移动使离子浓度增大的趋势,总的来说C(H+)减小,所以溶液的pH增大。若加入少量的纯醋酸,由于C(CH3COOH)增大,平衡正向移动,使C(CH3COOH)减小,溶液中的c(CH3COO—)增大。若加入少量的NaOH固体,由于发生反应:H++OH-=H2O消耗了溶液中的H+,使c(H+)减小,平衡正向移动使c(H+)又有所增加,但消耗的浓度大于平衡增加的浓度,总的来说溶液中c(H+)减小。若加入少量的CH3COONa固体,溶液中的c(CH3COO—)增大,平衡逆向移动,溶液中c(H+)减小,c(OH—)增大。(2)以KOH为电解质溶液的氢氧燃料电池中,通入H2的电极为负极,电池工作时其负极的电极反应式为2H2-4e—+4OH—=4H2O,通入O2的电极为正极,正极的电极反应式为O2+4e—+2H2O=4OH—。总反应式为2H2+O2=2H2O。
考点:考查燃料电池电极式的书写及外界条件对弱电解质电离平衡、离子浓度溶液酸碱性的影响的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《化学基本概.. | |