1、计算题 向一定量的Fe、FeO、Fe2O3混合物中加入1.00mol/l的盐酸100ml,可恰好使混合物完全溶解,放出224ml标准状况下的气体,向所得溶液中加入硫氰化钾,无血红色出现。
(1)若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量是多少?
(2)求原混合物中铁元素的质量分数 。
参考答案:(1)最终溶液为FeCl2
故n(Fe)= n(FeCl2)= 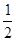 n(Cl-)=
n(Cl-)=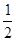 n(HCl)=
n(HCl)=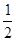 × 1.00mol/L×0.1L=0.05mol
× 1.00mol/L×0.1L=0.05mol
m(Fe)=0.05mol×56g/mol=2.8g
(2)HCl中H元素反应后一部分转化成H2,另一部分转化到H2O中,
故n(O)=n(H2O)=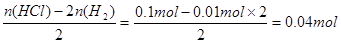
∴m(O)=0.64g
所以w(Fe)=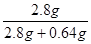 ×%=81.4%
×%=81.4%
本题解析:本题重点考查守恒法在化学计算中的应用
(1)混合物与盐酸恰好反应,所得溶液加入硫氰化钾,无血红色出现,说明没有Fe3+,故溶质只能为FeCl2,由氯元素的守恒可得:n(FeCl2)= 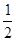 n(Cl-)=
n(Cl-)=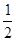 n(HCl)=
n(HCl)=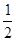 × 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol
× 1.00mol/L×0.1L=0.05mol,再由铁的守恒可知:n(Fe)= n(FeCl2)=0.05mol
(2)混合物与盐酸反应中,盐酸中的H元素一部分被置换生成氢气,别一部分与混合物中的氧元素结合生成水。故生成的水的物质的量为:n(H2O)=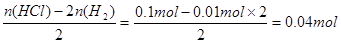
也就是混合物中氧元素的物质的量:n(O)=n(H2O)=0.04mol,质量为:m(O)=0.64g
综合可知,原混合物中铁元素的质量分数为:w(Fe)=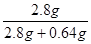 ×%=81.4%
×%=81.4%
本题难度:简单
2、简答题 查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
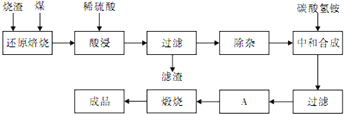
(1)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用______滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)=______.
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2
开始沉淀的pH
3.10
2.01
7.11
万全沉淀的pH
4.77
3.68
9.61
|
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,检验Fe3+已经除尽的试剂是______(除KSCN外).
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______.
参考答案:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫,生成的污染性气体为一氧化碳和二氧化硫,
故答案为:CO、SO2;
(2)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算得到滤液中亚铁离子物质的量,
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
1 5
0.10mol/L×0.012.04l n(Fe2+)
n(Fe2+)=0.00602mol
得到亚铁离子的浓度为0.00602mol0.02L=0.0301mol/L,
故答案为:酸式,0.0301mol/L;
(3)在空气中“酸浸”时间过长,溶液中Fe2+含量将下降的原因是亚铁离子在酸性溶液中被氧气氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(4)除去Fe3+和Al3+,依据图表中沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子除KSCN外,可以加入苯酚出现紫色证明铁离子的存在,
故答案为:7.11,苯酚;
(5)将溶液中Fe2+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥,
故答案为:洗涤或洗涤、干燥;
本题解析:
本题难度:一般
3、选择题 常温下,不能用铁制容器存放的物质是
A.浓硫酸
B.浓硝酸
C.CuSO4溶液
D.稀氨水
参考答案:C
本题解析:浓硫酸、浓硝酸都可以使铁制容器发生钝化能用铁制容器存放,A、B不选;
CuSO4+Fe=" Fe" SO4+ Cu?,CuSO4溶液不能用铁制容器存放,稀氨水不与铁反应可用铁制容器存放。答案选C.
本题难度:简单
4、选择题 在FeCl3、CuCl2和HCl的混合液中加入铁粉,待反应结束,所剩固体滤出后不能被磁铁吸引,则反应后溶液不可能大量存在的阳离子是
A.H+
B.Fe3+
C.Fe2+
D.Cu2+
参考答案:
本题解析:因铁的化学性质,可以与氯化铁和氯化铜反应:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu,由于反应结束后所剩固体不能被磁铁吸引,即铁粉反应完全,所以反应后溶液不能大量存在Fe3+?
点评:本题主要考查了铁的化学性质,需要强调的铁可以与氯化铁发生反应.
本题难度:简单
5、实验题 (16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:

[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+——Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.容量瓶(100 mL、 250mL),g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
 [实验记录]
[实验记录]
[交流与讨论]
(1)准备的实验用品中,一定不需要的仪器有(填序号)?;不需要的试剂有(填序号)?。
( 2)本实验所用的KMnO4标准溶液的物质的量浓度为?
2)本实验所用的KMnO4标准溶液的物质的量浓度为? ?。
?。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是?(填字母序号)。

(4)判断滴定终点的依据是?。
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲 洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量?(偏大、偏小、无影响)。
洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量?(偏大、偏小、无影响)。
(6)根据实验数据,计算该补血剂中铁元素的质量分数?。
参考答案:(16分)
⑴ e j?(2分 )? c? d? f(2分)
)? c? d? f(2分)
⑵1.200×10-2mol/L?(3分,有效数字不作要求)?⑶b(2分)
⑷滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色(2分)
⑸无影响(2分)
⑹16.8%(3分)
本题解析:略
本题难度:困难