1、选择题 把一定量的铁粉放入氯化铁溶液中,充分反应后所得溶液中Fe3+和Fe2+的浓度恰好相等,则反应的铁和未反应的Fe3+的物质的量之比为?
A.1︰3
B.1︰2
C.1︰1
D.3︰1
参考答案:A
本题解析:设未反应的Fe3+为amol,故生成的Fe2+为amol,Fe+2Fe3+=3Fe2+;反应的铁为a/3mol;故比值为1:3。
本题难度:简单
2、选择题 在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1,若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2,则P1和P2之间的关系是(?)
A.P1=P2
B.P1=2P2
C.P1=4P2
D.P1=8P2
参考答案:D
本题解析:由十字交叉法得:
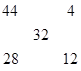
CO2和CO的物质的量比为1:3,2CO2+2Na2O2=2Na2CO3+O2↑,CO+Na2O2=Na2CO3,,即反应前4体积气体,反应后为0.5体积,P1=8P2,选D。
本题难度:一般
3、填空题 有下列物质:①钠,②过氧化钠,③碳酸钠,④碳酸氢钠。用序号填空:
(1)受热分解可得到 Na2CO3的是?。
(2)可用于漂白织物、麦秆、羽毛的是?。
(3)广泛用于玻璃、肥皂、造纸、纺织工业的是?。
(4)可用来提炼钛、铌、钽的是?。
(5)可作为飞船宇航员供氧剂的是?。
参考答案:④②③①②
本题解析:(1)受热分解可得到 Na2CO3的是碳酸氢钠,即答案选④。
(2)过氧化钠具有漂白性,可用于漂白织物、麦秆、羽毛,答案选②。
(3)广泛用于玻璃、肥皂、造纸、纺织工业的是碳酸钠,答案选③。
(4)钠是活泼的金属,可用来提炼钛、铌、钽,答案选①。
(5)过氧化钠能和水或CO2反应生成氧气,所以可作为飞船宇航员供氧剂,答案选②.
点评:该题是基础性试题的考查,主要是考查学生对教材基础知识的熟悉了解掌握程度,难度不大,学生记住即可。
本题难度:一般
4、选择题 关于钠的性质,下列叙述不正确的是(?)
A.钠是软金属,新切面易失去金属光泽并变灰暗
B.极易与水反应,因为它的氧化性很强
C.钠与硫化合时很剧烈,甚至会发生微爆声
D.实验室常将金属钠保存在煤油中
参考答案:B
本题解析:钠原子最外层只有1个电子,极易失去,表现出非常强的还原性,化学性质非常活泼。通常情况下,既可与某些非金属(如氧气、氯气、硫等),又可与某些化合物(如水、酸、盐等)发生剧烈反应,有的甚至发生爆炸。A正确,碱金属都很软,可用刀切,切面易被氧气氧化失去金属光泽并变灰暗。B不正确,钠与水反应实质是钠失去电子体现还原性。C正确。D正确,因为钠的密度比煤油的大,故保存在煤油中可以达到与空气隔绝的目的。
本题难度:简单
5、选择题 下列关于钠及其化合物的叙述正确的是? ( )。
A.将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色
B.用钠与空气反应制纯净的Na2O2,空气必须经过碱石灰处理后,才能与钠反应
C.钠与钠离子都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
参考答案:B
本题解析:Na2O2、Na2O分别加入酚酞试液中,均先与试液中的水反应生成碱而使试液变红色,但因Na2O2具有漂白性,最后又将变成红色的酚酞漂白,故A不正确。用Na与空气反应制Na2O2,空气中的CO2和水可与生成的Na2O2反应引入杂质,所以空气必须经碱石灰处理,故B正确。钠原子最外层只有一个电子,容易失去最外层电子形成钠离子,表现强还原性,而钠离子具有稳定的电子层结构,不具有还原性,只具有弱氧化性,故C不正确。D项反应中,氧化剂和还原剂均为Na2O2,故D不正确。
本题难度:一般