1、选择题 25 ℃、101 kPa下:①2Na(s)+O2(g)=Na2O(s)?;? ΔH1=-414 kJ/mol
②2Na(s)+O2(g)=Na2O2(s)?;? ΔH2=-511 kJ/mol?
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ; ΔH=-317 kJ/mol
参考答案:D
本题解析:A、Na2O 和Na2O2中阴阳离子个数比都为1:2,Na2O2中阴离子是O22-,错误;B、根据氧化还原反应原理最终都是Na从0价升高到+1价,每生成1摩尔Na2O 或Na2O2,都转移2摩尔电子,错误;C、钠和氧气在加热时反应生成Na2O2,错误;D、根据盖斯原理方程式①×2-②,-414×2+511=-317,正确。
本题难度:一般
2、选择题 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是
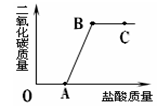
A.OA段没有发生任何反应
B.C点的溶液的pH=7
C.B点表示加入的盐酸与原溶液中的溶质恰好完全反应
D.C点溶液中的溶质只有NaCl
参考答案:C
本题解析:分析:可以根据物质之间相互作用的实验现象方面较小分析、考虑,从而得出正确的结论.
A、OA段发生了盐酸和氢氧化钠的反应
B、C点时,溶液中含有氯化钠和没有反应的盐酸,
C、B点在图上是一个转折点
D、C点时,溶质是氯化钠和氯化氢
解答:解:
A、OA段发生了化学反应,是盐酸和氢氧化钠反应.故A错误;
B、C点时,溶液中含有氯化钠和没有反应的盐酸,所以混合溶液显酸性,故B错误;
C、B点在图上是一个转折点,在此之后二氧化碳的质量没再改变,所以B点表示加入的盐酸与原溶液中的溶质恰好完全反应,故C正确.
D、C点时,是氯化钠溶液和盐酸的混合溶液,所以溶质是氯化钠和氯化氢,故D错误;
故选C
本题难度:一般
3、选择题 一定温度下,向饱和的NaOH溶液中加入少量的Na2O2固体,充分反应后恢复到原来的室温,下列叙述不合理的是?(?)
A.NaOH溶液浓度增大,并且放出O2
B.溶液的质量变小,有O2放出
C.NaOH的质量分数不变,有NaOH晶体析出
D.溶液中Na+的物质的量浓度不变,但物质的量减少了
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列各组物质混合后,不能生成NaOH的是
A.Na和H2O
B.Na2O2和H2O
C.Ca(OH)2溶液和Na2CO3溶液
D.Ca(OH)2溶液和NaCl溶液
参考答案:D
本题解析:钠和水反应生成氢氧化钠和氢气,过氧化钠和水反应生成氢氧化钠和氧气,Ca(OH)2溶液和Na2CO3溶液反应生成碳酸钙和氢氧化钠,D中物质不反应,答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,同时兼顾学生能力的培养,难度不大,记住常见的化学反应即可。
本题难度:简单
5、实验题 某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
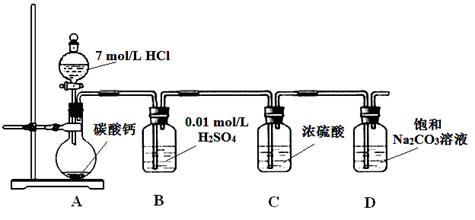
(1)D中产生NaHCO3的化学方程式是?。
(2)请结合化学平衡移动原理解释B中溶液的作用?。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 ?。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是?。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是?,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是?。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。
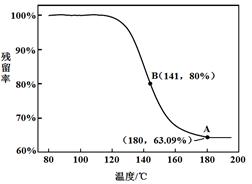
a. 根据A点坐标得到的结论是?。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))=?。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
参考答案:(1)Na2CO3+CO2+H2O = 2NaHCO3 (2分)
(2)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3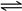 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
(3)① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分)
② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分)
合理(1分)
③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分)
补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分)
a.白色固体为NaHCO3(2分)
b.71:42(或1.69)(1分)
本题解析: A装置中反应制备CO2,其中有杂质HCl、H2O(g),B装置既减少CO2的溶解,又能吸收HCl,C装置干燥CO2,D装置制备碳酸氢钠。(3)Na2CO3和NaHCO3都能和Ca(OH)2反应生成白色沉淀,方案1不合理,方案2 Na2CO3和BaCl2反应有白色沉淀,NaHCO3和BaCl2反应有白色沉淀和气体,因此可以确定NaHCO3存在,但不能确定Na2CO3的存在。方案3 Na2CO3和NaHCO3溶液都显碱性,但水解程度不同,可通过比较PH值前后大小进行区别。乙同学在温度为180时,残留率正好符合NaHCO3完全分解的计算,B点根据差量法进行计算,设原来有100克NaHCO3,反应后剩余80克,减少20克是CO2和H2O的质量,列方程组计算。
本题难度:困难