1、简答题 科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量的99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成.现有a~h?8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:

(1)下列元素的原子间反应最容易形成离子键的是______,容易形成共价键的是______.
A.c和f?B.b和g?C.d和g?D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是______.
A.ea3?B.ag?C.fg3?D.dg4
(3)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种式量为120,该化合物熔化时破坏的是______(填化学键类型,下同),溶于水时破坏的是______.
2、推断题 A、B、C、D、E为五种短周期元素,其中A、B、C位于同一周期,A元素的气态氢化物足一种广泛应用的优质气体燃料,B元素的氢化物是用途最为广泛的溶剂。B元素可分别与A、C、D、E组成HB2型化合物,已知在DB2中,D与B的质量比为7:8;在EB2中,E与B的质量比为1:1。根据以上条件回答下列问题:
(1)请写出C单质分子的电子式_______;DB2晶体中化学键的类型为______;写出AE2的结构式_______。
(2)C的气态氢化物易液化,原因是:____________________。
(3)C和D结合可生成一种超硬物质,有关该物质性质的叙述中不正确的是___________。
①有润滑性 ②易磨损 ③抗腐蚀 ④强还原性 ⑤抗冷热
(4)B元素可分别与A、E形成多种阴离子。某溶液是由其中若干种阴离子组成的无机盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀硝酸,白色沉淀质量减少。
由此得出的结论是___________________
(5)E元素的一种氧化物可与过氧化钠及氯水发生氧化还原反应。 该氧化物与过氧化钠反应的化学方程式为_____________________;该氧化物与氯水反应的离子方程式为_____________________。
3、推断题 (三选一)【物质结构与性质】
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数:A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M 层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A的简单氢化物分子中中心原子采取____杂化,E的最高价氧化物分子的空间构型是____。
(2)B的氯化物的熔点比D的氯化物的熔点____(填“高” 或“低”),理由是____。
(3)A、B、C、D的第一电离能由小到大的顺序为 ____(用元素符号表示)。
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为__________(每个球均表示1个原子)。
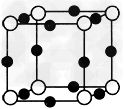
(5)F的价电子轨道表示式是_________,A、C形成的化合物具有高沸点和高硬度的性质,是一种新型无机非金属材料,则其化学式为_________。
4、选择题 元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m#n,且均为正整数)。下列说法正确的是
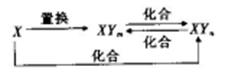
A.X一定是金属元素
B.(n-m)一定等于1
C.由X生成1molXYm时转移的电子数目一定为4NA
D.三个化合反应一定都是氧化还原反应
5、选择题 用4种溶液进行实验,下表中“溶液”与对应“操作及现象”关系错误的是
选项
| ?溶液
| 操作及现象
|
A
| AlCl3溶液
| 通入NH3,溶液变浑浊。再通入CO2,溶液不变澄清
|
B
| FeCl2溶液
| 滴入KSCN溶液,溶液不出现血红色,再通入Cl2,溶液变血红色
|
C
| 紫色石蕊试液
| 通入SO2,溶液先变红后褪色
|
D
| Ca(OH)2溶液
| 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
|