1、选择题 某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
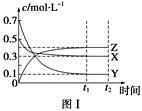
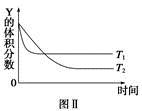
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
参考答案:B
本题解析:根据图Ⅰ,图Ⅱ推知X(g)+3Y(g)  2Z(g)
2Z(g)
ΔH<0,A错,B对;加压,平衡右移,C错;若恒温恒压,通入稀有气体,平衡左移;若恒温恒容通入稀有气体,平衡不移动,D错。
本题难度:一般
2、选择题 将1 mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
A.等于0.3 mol
B.等于0.15 mol
C.小于0.15 mol
D.大于0.15 mol,小于0.3 mol
参考答案:C
本题解析:移走0.5 mol O2和0.5 mol SO2相当于对容器进行减压一半操作,因此平衡逆向移动,所以SO3的物质的量小于0.15 mol。答案选C。
点评:改变影响移动的一个条件,平衡向减弱这种改变的方向移动。
本题难度:一般
3、选择题 某温度下,反应2A(g) B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后
B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后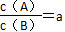 ,若改变某一条件,足够时间后反应再次达到平衡状态,此时
,若改变某一条件,足够时间后反应再次达到平衡状态,此时 ,下列叙述正确的是? ( )。
,下列叙述正确的是? ( )。
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
B.若a=b,则B容器中一定使用了催化剂
C.若其他条件不变,升高温度,则有a<b
D.若保持温度、压强不变,充入惰性气体,则有a>b
参考答案:B
本题解析:A项中增加B气体,相当于压强增大,平衡正向移动,所以b<a,A错误。升高温度,平衡正向移动,则b<a,C错误。若保持温度、压强不变,充入惰性气体,则体积增大,平衡向气体分子数增多的方向移动,即逆向移动,则a<b,D错误。
本题难度:一般
4、选择题 下列事实不能用勒沙特列原理解释的是(?)
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
A.①③④
B.②⑥⑦
C.③④⑤
D.②③⑤
参考答案:B
本题解析:勒沙特列原理是化学平衡移动原理,能用该原理解释的事实具备条件是涉及可逆反应平衡移动且符合平衡移动原理。①氯化铁溶液存在平衡:FeCl3+3H2O Fe(OH)3+3HCl,盐类的水解吸热,升高温度平衡正向移动,盐酸易挥发,生成氢氧化铁固体,能用勒沙特列原理解释;②铁在潮湿的空气中能形成原电池,加快腐蚀,不能用勒沙特列原理解释;③NaHSO4溶液加水稀释,涉及水的电离平衡移动,能用勒沙特列原理解释;④常温下,醋酸溶液存在电离平衡:CH3COOH
Fe(OH)3+3HCl,盐类的水解吸热,升高温度平衡正向移动,盐酸易挥发,生成氢氧化铁固体,能用勒沙特列原理解释;②铁在潮湿的空气中能形成原电池,加快腐蚀,不能用勒沙特列原理解释;③NaHSO4溶液加水稀释,涉及水的电离平衡移动,能用勒沙特列原理解释;④常温下,醋酸溶液存在电离平衡:CH3COOH CH3COO-+H+加水稀释,平衡正向移动,能用勒沙特列原理解释;⑤Na2CO3溶液存在CO32-的水解平衡:CO32-+H2O
CH3COO-+H+加水稀释,平衡正向移动,能用勒沙特列原理解释;⑤Na2CO3溶液存在CO32-的水解平衡:CO32-+H2O  ?HCO3-+OH-,加CaCl2溶液,钙离子和碳酸根反应生成碳酸钙沉淀,使平衡向左移动,能用勒沙特列原理解释;⑥对于H2+I2
?HCO3-+OH-,加CaCl2溶液,钙离子和碳酸根反应生成碳酸钙沉淀,使平衡向左移动,能用勒沙特列原理解释;⑥对于H2+I2 2HI的平衡体系,加压,平衡不移动,不能用勒沙特列原理解释;⑦在双氧水的分解实验中加MnO2作催化剂能使分解速率显著加快,不能用勒沙特列原理解释;综上所述选B。
2HI的平衡体系,加压,平衡不移动,不能用勒沙特列原理解释;⑦在双氧水的分解实验中加MnO2作催化剂能使分解速率显著加快,不能用勒沙特列原理解释;综上所述选B。
本题难度:一般
5、填空题 反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率如下所示:
2C(g)+2D(g)在四种不同情况下的反应速率如下所示:
①v(A)= 0.15?mol/(L s);②v(B)=0.6mol/(L
s);②v(B)=0.6mol/(L s);③v(C)= 0.4?mol(L
s);③v(C)= 0.4?mol(L s);④v(D)=0.45?mol/(L
s);④v(D)=0.45?mol/(L s)。该反应进行的快慢顺序为_________。
s)。该反应进行的快慢顺序为_________。
参考答案:④>③=②>①
本题解析:
本题难度:一般