1、选择题 短周期元素X、Y、Z中,X元素位于Y的前一周期,其原子最外电子层只有一个电子,Y原子的次外层电子数是最外层电子数的1/3;Z原子的最外层电子数与Y相同。下列X、Y、Z之间形成化合物的化学式不正确的是(? )
A.X2Z
B.ZY3
C.X2Y2
D.XZ2
参考答案:D
本题解析:本题考查元素在周期表中的位置,体现位置和结构之间的关系。由题意可知X元素为H,Y为O,Z为S。H2S、SO3、H2O2。D错误,不符合事实。
本题难度:简单
2、选择题 第119号某未知元素,有人称之为“类钫”。根据周期表结构及元素性质的变化趋势,下列有关“类钫”的预测说法错误的是(? )
A.“类钫”在化合物中呈+1价
B.类钫具有放射性
C.单质与水反应较为缓慢
D.类钫最高价氧化物对应的水化物是强碱
参考答案:C
本题解析:119―2-8-8-18-18-32-32=1,所以该元素应该位于第八周期,第IA。同主族元素自上而下金属性逐渐增强,所以选项C是错误的。答案C。
本题难度:简单
3、选择题 下列说法正确的是
A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片
B.工业上由NH3制碳铵属于氮的固定中的人工固氮
C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
D.S、P、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
参考答案:A
本题解析:A.Si晶体可用于制作计算机芯片,正确;B.氮的固定是指由游离态的氮生成氮的化合物的过程,错误;C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐是增强的,与元素非金属性强弱对应的是最高价氧化物对应水化物的酸性,错误;D.正确的表述是P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强,错误;
本题难度:一般
4、选择题 L—T 5种短周期元素的信息如下表,有关叙述正确的是(?)
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.112
| 0.104
| 0.066
|
主要化合价
| +2
| +3
| +2
| +6、+4、-2
| -2
|
?
A.与稀盐酸反应的剧烈程度:L单质<Q单质
B.热稳定性:H2T<H2R
C.沸点:H2T>H2R
D.L2+与R2-的核外电子数相等
参考答案:C
本题解析:根据题目提供的元素的原子半径及化合价的信息可知:L是Mg;M是Al;Q是Be;R是S;T是O。A.由于金属性Mg>Al,所以与稀盐酸反应的剧烈程度:L单质>Q单质。错误。B.非金属性O>S,所以热稳定性:H2T热稳定性:H2T>H2R 。错误。C.H2O、H2S是同种元素形成的化合物,一般情况下结构相似的物质,相对分子质量越大,物质的分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,即物质的熔沸点就越高沸点。但是由于O的电负性大而原子半径又小,所以在水分子之间还存在氢键,增加了分子间的相互作用力,使其熔沸点较高。因此沸点:H2O>H2S。正确。D.Mg2+核外电子排布是2、8,而S2-的核外电子排布是2、8、8.因此电子数不相等。错误。
本题难度:一般
5、填空题 (1)32Ge原子核外电子有?种不同的运动状态,原子核外电子排布式为?。
(2)写出氮原子的核外电子的轨道表示式?。
(3)写出CCl4的电子式?,其中心原子的杂化方式?。
参考答案:(1)32? 1s22s22p63s23p63d104s24p2;
(2)1s 2s
2s 2p
2p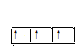
(3)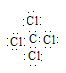 sp3杂化
sp3杂化
本题解析:(1)电子的运动状态是由电子层数、电子亚层、原子轨道、自旋方向所决定的,所以任何一个原子里不存在运动状态相同的两个电子,所以核外有多少电子,就有多少种运动状态,32Ge原子核外电子有32种不同的运动状态,原子核外电子排布式为1s22s22p63s23p63d104s24p2;
(2)氮原子的核外电子的轨道表示式1s 2s
2s 2p
2p
(3)根据电子式的书写原则,CCl4的电子式为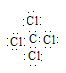 , CCl4的空间构型是正四面体,其中心原子的杂化方式sp3杂化。
, CCl4的空间构型是正四面体,其中心原子的杂化方式sp3杂化。
本题难度:一般