1、选择题 X、Y、Z是由短周期元素组成的单质,甲、乙是常见的化合物,已知有如下反应:①X + Z→乙;②Y+Z→甲;③X+甲→Y+乙。下列叙述正确的是
A.甲中不含组成X的元素,乙中不含组成Y的元素
B.单质X一定是金属
C.X、Y、Z不可能都是非金属单质
D.如果Y是氢,X是铝,则甲是AlCl3
参考答案:
A
本题解析:略
本题难度:一般
2、填空题 常温下,A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,B、C、D都是含A元素的化合物,转化关系如图所示.
(1)分别写出A、B、C、D的化学式:
A______;B______.
C______;D______.
(2)写出B的电离方程式:______.
(3)写出下列反应的离子方程式
A→B______.
D→A______.
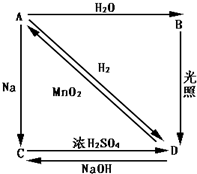
参考答案:A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,应为Cl2,和水反应生成B易分解,应为HClO,D为HCl,由转化关系可知C为NaCl,
(1)由以上分析可知A为Cl2,B为HClO,C为NaCl,D为HCl,故答案为:Cl2;HClO;NaCl;HCl;
(2)HClO为弱酸,部分电离,电离方程式为HClO?H++ClO-,故答案为:HClO?H++ClO-;
(3)氯气和水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O?H++Cl-+HClO,浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O,
故答案为:Cl2+H2O?H++Cl-+HClO;MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O.
本题解析:
本题难度:一般
3、简答题 A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素.
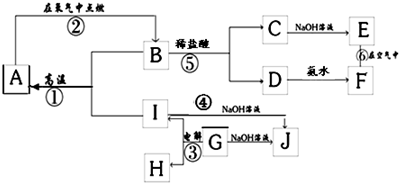
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是______.
(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)______.
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:______;
反应④的离子方程式:______;
反应⑥的化学方程式:______;
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是______(填序号).
参考答案:G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C、D分别和碱反应生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,铁元素位于第四周期第Ⅷ族,故答案为:第4周期Ⅷ族;
(2)C是氯化亚铁,亚铁离子不稳定易被氧化生成铁离子,铁离子能和硫氰化钾溶液发生反应生成络合物而使其溶液呈血红色,所以检验亚铁离子的方法是:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+,
故答案为:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+;
(3)高温下,铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe,
铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe、2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铝热反应和燃烧反应都是放热反应,故选①②.
本题解析:
本题难度:一般
4、推断题 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
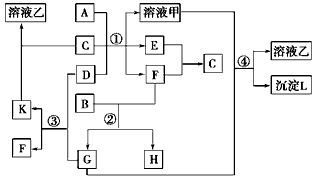
(1)A、B、C、D代表的物质分别为_______、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是__________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为__________________;
(5)反应④的离子方程式为___________________。
参考答案:(1)Al;C;H2O;Na2O2
(2)2Na2O2+2H2O==4NaOH+O2↑、2Al+2NaOH+6H2O==2Na[Al(OH)4]+3H2↑
(3)CO2;CO
(4)Na2CO3
(5)CO2+2[Al(OH)4]-+OH-+H2O==CO32-+Al(OH)3↓+H2O
本题解析:
本题难度:一般
5、简答题 Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,D为化合物,它的焰色反应为黄色,C和G混合冒白烟并生成A
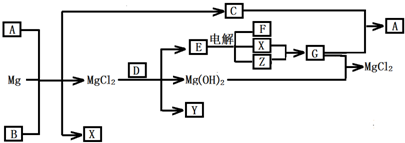
(1)写出下列物质的化学式:A______?Y______
(2)写出C的电子式______
(3)写出MgCl2与D反应的化学方程式______
(4)请用电离或水解平衡解释A+B+Mg→C+X+MgCl2的原因______.
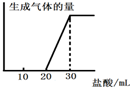
(5)将1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示则原F溶液的浓度为______mol/L.
参考答案:本题的题眼是C和G混合冒白烟并生成A,G与氢氧化镁反应生成氯化镁,则G为氯化氢,判断XY为氢气和氯气;从而推断C为碱性气体NH3,A为NH4Cl;D的焰色反应为黄色,说明含有钠元素,能和氯化镁反应生成氢氧化镁、单质气体Y、和能电解的化合物E,结合XY为氢气和氯气可知E为NaCl;所以能和氯化镁生成碱和气体的含钠化合物只能是过氧化钠,推断D为过氧化钠,Y为氧气,金属镁和A氯化铵反应生成氯化镁、氢气、和氨气,判断B为水,综合分析判断转化关系中的各种物质为:
A、NH4Cl;B、H2O;C、NH3;D、Na2O2;E、NaCl;F、NaOH;G、HCl;X、H2;Y、O2;Z、Cl2;依据判断出的各物质及性质回答各步问题:
(1)依据上述推断可知A为NH4Cl,Y为O2,故答案为:NH4Cl;O2;?
(2)推断C为氨气所以电子式为
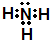
,故答案为:
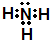
;
(3)氯化镁与D过氧化钠反应的化学方程式结合生成产物为氢氧化镁、氧气、氯化钠,根据书写化学方程式的要求配平写出:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑,
故答案为:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑;
(4)A+B+Mg→C+X+MgCl2的化学方程式为,2NH4Cl+Mg=2NH3↑+H2↑+MgCl2,NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,反应放出热量最终逸出NH3,
故答案为:NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,最终逸出NH3;
(5)F溶液为氢氧化钠溶液,通入1mol二氧化碳气体反应后,滴入盐酸开始无气体生成,最后有气体生成到不变.过程中发生的化学反应为:CO2+2NaOH=Na2CO3+H2O;由图象分析可知,消耗20ml盐酸无气体放出,说明 二氧化碳与氢氧化钠反应生成的产物中无碳酸氢钠,滴入盐酸发生反应OH-+H+=H2O? CO32-+H+=HCO3-? HCO3-+H+=CO2↑+H2O,图象中的数据显示,生成二氧化碳消耗的氯化氢与碳酸钠生成碳酸氢钠消耗的氯化氢相同,所以原溶液中剩余氢氧化钠,剩余的氢氧化钠需要10ml的盐酸中和,根据碳元素守恒,二氧化碳气体物质的量为1mol,和氢氧化钠反应生成碳酸钠为1mol,生成碳酸氢钠为1mol,消耗氯化氢1mol;根据反应可知最后放出二氧化碳1mol,消耗氯化氢1mol,依据盐酸消耗的体积分析判断,原氢氧化钠溶液剩余1mol氢氧化钠,因此元氢氧化钠溶液中共含有氢氧化钠为3mol,浓度为3mol/L,
故答案为:0.3mol/L.
本题解析:
本题难度:一般