1、推断题 A是自然界存在最广泛的IIA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)A与水反应的化学方程式为_________,E与水反应的化学方程式为_____;
(2)F的化学式为_________,G和D的电子式分别为_________和__________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法______________。
参考答案:(1)Ca+2H2O=Ca(OH)2+H2↑;NaH+H2O=NaOH+H2↑
(2)CaCO3;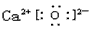 ?;
?;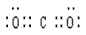
(3)Na2CO3,NaHCO3
(4)将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就制得单质钙。
本题解析:
本题难度:一般
2、推断题 据下列信息回答问题:
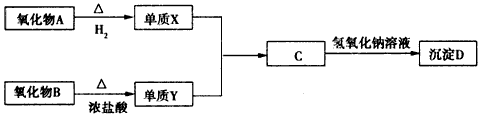
其中氧化物A是红色粉末,B是黑色粉末,单质X在Y中燃烧有棕黄色烟生成,棕黄色烟溶于水,溶液呈黄绿色。
(1)Y的结构式是_________,B是___________(填化学式)。
(2)C的水溶液显酸性的原因是(用离子方程式表示):___________________
(3)电解法制备氧化物A,原理如下图所示
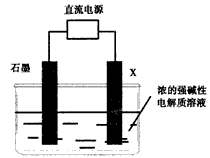
则阳极电极反应可以表示为____________。
(4)最新实验研究加热条件下用液态肼(N2H4)与新制D可制备纳米级A,同时放出N2。该制法的化学方程式为:_____________________。
(5)利用电解C溶液可提纯X物质,在该电解反应中阳极物质是________________;阴极的电极反应为
__________________。
参考答案:(1)Cl-Cl;MnO2
(2)Cu2++2H2O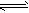 Cu(OH)2+2H+
Cu(OH)2+2H+
(3)2Cu-2e-+2OH-=Cu2O+H2O
(4)4Cu(OH)2+N2H4 2Cu2O+N2↑+6H2O
2Cu2O+N2↑+6H2O
(5)粗铜;Cu2++2e-=Cu
本题解析:
本题难度:一般
3、简答题 下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一.
请按要求填空:
(1)写出下列物质的化学式
A?、E?、F?、K?;
(2)写出反应5的化学方程式?
(3)1molB通过反应2得到1molF,B中F的质量分数为72%,则B的化学式为?.
(4)写出反应4的离子方程式?.
参考答案:A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应5是工业制X的主要反应之一,则X为硝酸,反应5为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应4为Ag与硝酸的反应,(1)由上述推断可知A为H2O,E为N2,F为Ag,K为AgCl,故答案为:H2O;N2;Ag;AgCl;
(2)反应5为氨气的催化氧化反应,氨气与氧气反应生成一氧化氮和水,反应的方程式为4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)1molB通过反应2得到1molF,设B的化学式为AgNx,则108108+14x×100%=72%,解得x=3,所以B的化学式为AgN3,故答案为:AgN3;?
(4)反应4为Ag与硝酸的反应,结合反应6可知,Ag与硝酸反应生成NO2,离子反应为Ag+2H++NO3-═Ag++NO2↑+H2O,故答案为:Ag+2H++NO3-═Ag++NO2↑+H2O.
本题解析:
本题难度:一般
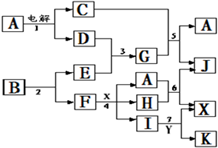
4、填空题 (10分)物质A~Z有下图所示的转化关系(部分反应物与产物已略去)。其中,常温下B、C为气体单质,Y为固体单质,Y是电子工业中常用的半导体材料。F是具有磁性的黑色晶体。E的水溶液与M混合后得到N,N经过干燥脱水可得到一种常用于实验室和袋装食品、瓶装食品等的干燥剂,K的焰色反应为紫色,A的焰色反应为黄色。
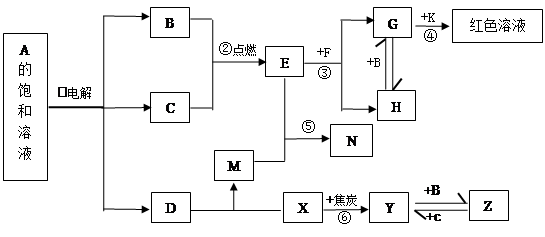
请回答:
(1)利用①反应进行化工生产的工业名称为??,K的化学式?;D的电子式________________;
(2)反应①的离子方程式?;
(3)向H的水溶液中加入足量氨水并将溶液露置在空气中,观察到的现象是?;向相同体积相同浓度的两份G溶液中分别滴加相同PH的氨水和D溶液,当沉淀最大量时所加入的氨水和D溶液的体积分别为V1、V2,则V1、V2的大小关系V1?V2。
(4)写出反应⑥的化学方程式?。
(5)N为比碳酸还弱的酸,设计实验证明,简述实验过程和现象?。
参考答案:(10分)?(1)?氯碱工业?,? KSCN?;?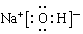 ?
?
(2)2Cl-+2H2O? ?H2↑ + Cl2↑+ 2OH-;
?H2↑ + Cl2↑+ 2OH-;
(3)先有白色沉淀生成,后迅速变为灰绿色,最终变为红褐色。;? <
(4) SiO2 +2 C? ?Si + 2CO↑。
?Si + 2CO↑。
(5)向硅酸钠溶液中通入过量的二氧化碳,有白色沉淀生成。
本题解析:本题是无机框图题,关键是找准突破点。Y为固体单质,Y是电子工业中常用的半导体材料,则Y是Si。所以根据反应⑥可知,这是工业上制取单质的方法,因此X是二氧化硅,B是氯气,C是氢气,Z是四氯化硅。F是具有磁性的黑色晶体,所以F是四氧化三铁。根据反应②可知E是氯化氢。所以G是氯化铁,H是氯化亚铁,被氯气氧化生成氯化铁。由于K的焰色反应为紫色,所以根据反应④的现象可知,K是KSCN溶液。A的焰色反应为黄色,所以根据反应①的条件可知,A应该是氯化钠,电解饱和食盐水即生成氢气、氯气和氢氧化钠,则D是氢氧化钠。二氧化硅和氢氧化钠溶液反应生成硅酸钠,因此M是硅酸钠。盐酸和硅酸钠反应生成硅酸,所以N是硅酸。
本题难度:一般
5、填空题 已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体。
各物质间的转化关系如下图所示(某些条件已略去)。
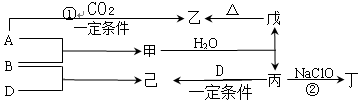
请回答:
(1)单质B的组成元素在周期表中的位置是 。
(2)丁的电子式为?。
(3)反应①的化学方程式为?。
(4)丁的燃烧产物对环境无污染。丁—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入丁的电极反应式是:
,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(5)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
?。
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: 。(精确到小数点后三位)
参考答案:

本题解析:短周期单质:Na、Mg、Al、C、H2、O2、F2、N2;丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,丙为NH3,丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,丁为N2H4,乙是一种耐火材料,耐火材料为Al2O3、MgO;结合图示,甲和水反应生成氨气,甲为Mg3N2,Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑;A为Mg,2Mg+CO2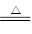 2MgO+C;B为N2,3Mg+N2
2MgO+C;B为N2,3Mg+N2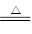 Mg3N2;D为O2,己为NO;4NH3+5O2
Mg3N2;D为O2,己为NO;4NH3+5O2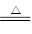 ? 4NO+6H2O;
? 4NO+6H2O;
A、Mg,B、N2,D、O2,甲、NO,乙、MgO,丙、NH3,丁、N2H4,戊、MgO,己、NO。
本题难度:一般