1、推断题 A是自然界存在最广泛的IIA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)A与水反应的化学方程式为_________,E与水反应的化学方程式为_____;
(2)F的化学式为_________,G和D的电子式分别为_________和__________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法______________。
2、推断题 据下列信息回答问题:
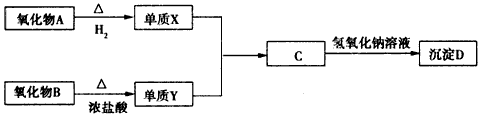
其中氧化物A是红色粉末,B是黑色粉末,单质X在Y中燃烧有棕黄色烟生成,棕黄色烟溶于水,溶液呈黄绿色。
(1)Y的结构式是_________,B是___________(填化学式)。
(2)C的水溶液显酸性的原因是(用离子方程式表示):___________________
(3)电解法制备氧化物A,原理如下图所示
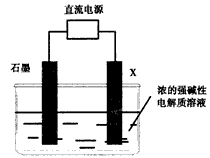
则阳极电极反应可以表示为____________。
(4)最新实验研究加热条件下用液态肼(N2H4)与新制D可制备纳米级A,同时放出N2。该制法的化学方程式为:_____________________。
(5)利用电解C溶液可提纯X物质,在该电解反应中阳极物质是________________;阴极的电极反应为
__________________。
3、简答题 下图中A是一种无色液体,G是一种极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应5是工业制X的主要反应之一.
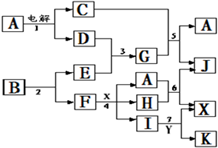
请按要求填空:
(1)写出下列物质的化学式
A?、E?、F?、K?;
(2)写出反应5的化学方程式?
(3)1molB通过反应2得到1molF,B中F的质量分数为72%,则B的化学式为?.
(4)写出反应4的离子方程式?.
4、填空题 (10分)物质A~Z有下图所示的转化关系(部分反应物与产物已略去)。其中,常温下B、C为气体单质,Y为固体单质,Y是电子工业中常用的半导体材料。F是具有磁性的黑色晶体。E的水溶液与M混合后得到N,N经过干燥脱水可得到一种常用于实验室和袋装食品、瓶装食品等的干燥剂,K的焰色反应为紫色,A的焰色反应为黄色。
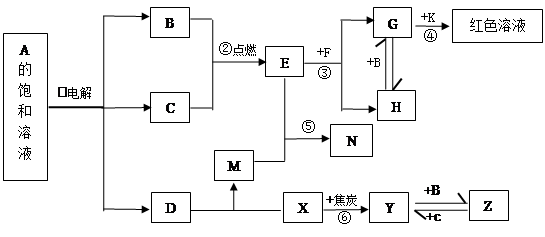
请回答:
(1)利用①反应进行化工生产的工业名称为??,K的化学式?;D的电子式________________;
(2)反应①的离子方程式?;
(3)向H的水溶液中加入足量氨水并将溶液露置在空气中,观察到的现象是?;向相同体积相同浓度的两份G溶液中分别滴加相同PH的氨水和D溶液,当沉淀最大量时所加入的氨水和D溶液的体积分别为V1、V2,则V1、V2的大小关系V1?V2。
(4)写出反应⑥的化学方程式?。
(5)N为比碳酸还弱的酸,设计实验证明,简述实验过程和现象?。
5、填空题 已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体。
各物质间的转化关系如下图所示(某些条件已略去)。
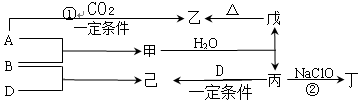
请回答:
(1)单质B的组成元素在周期表中的位置是 。
(2)丁的电子式为?。
(3)反应①的化学方程式为?。
(4)丁的燃烧产物对环境无污染。丁—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入丁的电极反应式是:
,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(5)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
?。
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: 。(精确到小数点后三位)