1、选择题 下列分子中所有原子都满足最外层8电子结构的是
[? ]
A.光气(COCl2)
B.六氟化硫
C.二氟化氙
D.三氟化硼
参考答案:A
本题解析:
本题难度:简单
2、推断题 H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是?;NH4+中氮原子轨道的杂化类型为________。
 (2)CO、N2的结构可表示为:?
(2)CO、N2的结构可表示为:?
两者的键能数据:(单位kJ/mol)
?
| A—B
| A=B
| 
|
CO
| 357.7
| 798.9
| 1071.9
|
N2
| 154.8
| 418.4
| 941.7
|
?
结合数据说明CO比N2活泼的原因?。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是?。
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。?该物质的化学式为:?。

参考答案:(8分)
(1)C O N?(1分) ;sp3杂化(1分)
(2)CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。(2分)
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,在气化时要破坏氢键,所以需要更多能量,沸点前者较高。
(4)C3N4(2分)
本题解析:
(1)由于N原子最外层是半充满结构,能量比较低,难以失电子,所以第一电离能比相邻原子的大,故顺序为C O N?;根据价层电子对互斥理论可以NH4+中氮sp3杂化;
(2)根据表中的数据可知:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
(4)晶胞中微粒数计算为:碳,8*11/8+4*1/2=3,氮:4个,故化学式为C3N4。
本题难度:一般
3、填空题 氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为?。
②BH—4的空间构型是?(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是?(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是?(多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: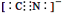
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,说明C60是?分子(选填:“极性”、“非极性”);
②1mol C60分子中,含有σ键数目为?。
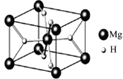
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为?cm3[用a、NA表示阿伏加德罗常数]。
参考答案:
(1)①1s22s22p63s23p63d2(或[Ar]3d2)?②正四面体
(2)abcd
(3) ①非极性?②90NA或5.418×1024
(4)52/aNA
本题解析:(1)BH4-中心原子杂化方式为sp3,故空间构型为正四面体;(2)a、NH3分子中N原子价电子对数为(5+3)/2=4,故采用sp3杂化,正确;b、NH3分子间存在氢键,故熔沸点较高,正确;c、[Cu(NH3)4]2+离子中,Cu是中心原子,N原子是配位原子,正确;d、CN—与氮气为等电子体,电子式同氮气的电子式,正确。(3)相似相溶是分子晶体的性质,苯和二硫化碳是非极性分子,故其为分子晶体;采用均摊法计算σ键数目:1个碳原子形成3个σ键,每个σ键2个碳原子公用,故有60×3×1/2=90;(4)计算出晶胞的质量,再根据密度即可求出晶胞的体积。晶胞中含有MgH2微粒数为2个:Mg? 8×1/8+1=2? H? 4×1/2+2=4,列式为2/NA=va/26? v=52/aNAcm3
本题难度:一般
4、选择题 下列物质的电子式书写正确的是( )
A.次氯酸
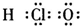
B.过氧化
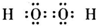
C.氨基
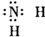
D.二氧化碳
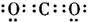
参考答案:D
本题解析:
本题难度:简单
5、填空题 (7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是?(填符号),画出配合物离子 中的配位键?。
中的配位键?。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为?,BCl3分子的立体结构为?。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子?,三角锥形分子?,V型分子?。
参考答案:(7分)(1)? Fe3+?1分?,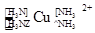 ? 1分。
? 1分。
(2)正四面体? 1分,正三角形(平面三角形)1分。
(3)CH4或CF4?1分,??NH3或NF3? 1分,?H2O? 1分
本题解析:(1)提供空轨道接受孤电子对的微粒是Fe3+。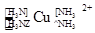
(2) H30+中VSEPR模型名称为正四面体,BCl3分子的立体结构为正三角形
(3)举例:正四面体分子:CH4,?三角锥形分子NH3,?V型分子:H2O
本题难度:一般