1、简答题 氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN-等形式存在于废水中.某化学小组同学对含氰化物废水处理进行研究.
I.查阅资料:含氰化物的废水破坏性处理方法.
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.
II.实验验证:破坏性处理CN-的效果.
化学兴趣小组的同学在密闭系统中用如图装置进行实验,以测定CN-被处理的百分率,实验步骤如下:

步骤1:取一定量废水进行加热蒸发、浓缩.
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol?L-1)倒入甲中,塞上橡皮塞.
步骤3:______.
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞.
步骤5:打开活塞K,通一段时间N2,关闭活塞K.
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式______.
(2)完成步骤3______.
(3)丙装置中的试剂是______,丁装置的目的是______.
(4)干燥管Ⅱ的作用是______.
(5)请简要说明实验中通入N2的目的是______.
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为______.
参考答案:(1)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
(2)装置丁的作用是加热利用铜与氯气反应,除去乙中反应生成的气体中混有的氯气,故乙中反应之前应先点燃酒精灯对丁装置加热,防止干燥管Ⅰ吸收氯气,影响二氧化碳质量的测定;
故答案为:点燃酒精灯对丁装置加热;
(3)实验原理为测量干燥管Ⅰ吸收的二氧化碳的质量确定对CN-的处理,由于乙装置中产生N2、CO2、Cl2、H2O,氯气与水都能被碱石灰吸收,影响二氧化碳质量的测定.所以进入干燥管Ⅰ的气体应除去氯气与水,用浓硫酸吸水,用铜网除去氯气,故丙装置中的试剂是浓硫酸,丁装置的目的是除去Cl2;
故答案为:浓硫酸;除去Cl2;
(4)干燥管Ⅰ的作用是吸收CO2,测定生产的二氧化碳的质量,空气中的CO2、水蒸气进入干燥管Ⅰ干扰实验,干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干扰实验;
故答案为:防止空气中的水和CO2进入干燥管I中影响对CO2的测量;
(5)装置中残留有CO2未被完全吸收,导致测定的二氧化碳质量偏低,通入N2使装置中的CO2全部被排到干燥管I中被吸收,减少误差;
故答案为:使装置中的CO2全部被排到干燥管I中被吸收,减少误差;
(6)干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为1.408g44g/mol=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为0.032mol0.04mol×100%=80%;
故答案为:80%.
本题解析:
本题难度:一般
2、实验题 为确定某液态有机物X(分子式为C2H6O2)的结构,某同学准备按下列程序进行探究.已知: ①一个碳原子上连两个羟基(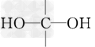 )的物质不稳定;②分子中不存在过氧键(—O—O—). ?
)的物质不稳定;②分子中不存在过氧键(—O—O—). ?
(1)根据价键理论预测X的可能结构为________________________?.
(2)某同学设计如图实验装置来确定X的结构(表格可不填满).
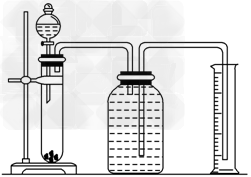
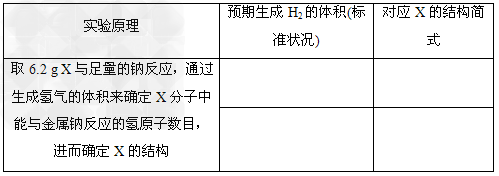
参考答案:(1)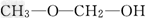 、
、
(2)
本题解析:
本题难度:一般
3、选择题 用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
[? ]
装置
实验
A.

干燥氯气
B.
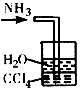
吸收NH3
C.
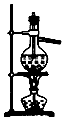
石油的分馏
D.
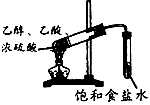
制取乙酸乙酯
参考答案:B
本题解析:
本题难度:一般
4、选择题 有三种溶液分别是①、②、③,在Na2CO3溶液中加入①有白色沉淀产生,继续加入②时白色沉淀全部溶解同时产生气泡,再加入③时又产生白色沉淀.设每次加入反应物都能完全反应,则上述①②③三溶液应是下列的哪一组( )
| ① | ② | ③
(A)
BaCl2
HNO3
Na2SO4
(B)
CaCl2
HNO3
KCl
(C)
KCl
H2SO4
CaCl2
(D)
BaCl2
H2SO4
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A
本题解析:
本题难度:简单
5、简答题 (1)只用一种试剂______,就可以鉴别出Na2CO3、NaOH、AgNO3、Na2S及NaNO3这五瓶无色溶液;
(2)不用任何试剂及仪器就可以确定以下各种等物质的量浓度的溶液中pH由小到大的顺序,其顺序是______;
A、NaClB、CH3COONaC、NaHSO4D、Na2CO3E、NaClO
(3)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题:当它们pH相同时,其物质的量浓度由大到小的排列是______;当它们的物质的量浓度相同时,其pH由大到小的排列是______;中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为______.
参考答案:(1)Na2CO3、NaOH、AgNO3、Na2S及NaNO3五瓶无色溶液,可以使用氯化铁溶液进行鉴别:碳酸钠与氯化铁反应生成红褐色沉淀和气体、氢氧化钠与氯化铁生成红褐色沉淀、硝酸银与氯化铁生成白色沉淀、硫化钠与氯化铁溶液反应生成硫单质,且氯化铁溶液褪色、硝酸钠与氯化铁溶液没有明显现象,
故答案为:FeCl3(aq);
(2)A、NaCl B、CH3COONa C、NaHSO4D、Na2CO3E、NaClO中,显示酸性的有:C、NaHSO4;显示中性的为:A、NaCl;显示碱性的为:B、CH3COONa、D、Na2CO3 E、NaClO;显示碱性的三种物质都为强碱弱酸盐,根据“越弱越水解”可知,水解程度增大,碱性最强的为D、Na2CO3 ,其次为E、NaClO,水解程度最小,碱性最弱的是B、CH3COONa,所以各溶液的pH大小关系为:C<A<B<E<D,
故答案为:C<A<B<E<D;
(3)①CH3COOH、②HCl、③H2SO4三种溶液,当它们pH相同时,要求溶液中氢离子浓度相同,醋酸为弱电解质,只能部分电离出氢离子,所以醋酸的浓度最大,其次是盐酸为一元强酸、硫酸为二元强酸,所以氯化氢浓度大于硫酸,即物来源:91exam .org质的量浓度由大到小的排列是①>②>③;
当它们的物质的量浓度相同时,溶液在氢离子浓度越大,溶液的pH越小,所以醋酸中氢离子浓度最小,溶液pH最大,其次是盐酸为一元酸,氢离子浓度小于硫酸,盐酸的pH大于硫酸,所以pH大小关系为:①>②>③;
中和同一烧碱溶液,根据中和反应实质,需要氢离子的物质的量相等,由于三种酸溶液同浓度,且醋酸、盐酸为一元酸、硫酸为二元酸,所以需要三种溶液的体积关系为:①=②=2③,
故答案为:①>②>③; ①>②>③; ①=②=2③.
本题解析:
本题难度:简单