1、选择题 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是?

[?]
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)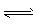 Z(g)
Z(g)
参考答案:C
本题解析:
本题难度:一般
2、选择题 一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)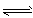 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
[? ]
A.以X浓度变化表示的反应速率为0.001mol/(L·s)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
参考答案:A
本题解析:
本题难度:一般
3、选择题 在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)? Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
参考答案:C
本题解析:A、平衡常数数据分析,平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故A错误;B、恒温恒压下,向容器中再充入少量的Ar,压强增大保持恒压,平衡向气体体积增大的方向进行,上述平衡将逆向移动,故C错误;C、80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol?L-1,Qc=c(Ni(CO)4)/c4(CO)=0.5/0.54=8>2,说明平衡逆向进行,则此时v(正)<v(逆),故C正确;D、恒温恒容下,向容器中再充入少量的Ni(CO)4(g),相当于增大压强平衡正向进行,达到新平衡时,CO的百分含量将减小,故D错误。
本题难度:一般
4、选择题 已知:4NH3+?5O2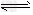 4NO+?6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)
4NO+?6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)
(mol L-1
L-1 min-1)表示,则正确的关系是
min-1)表示,则正确的关系是
A.?4/5(NH3)=v(O2)
B.?5/6(O2)=v(H2O)
C.?2/3(NH3)=v(H2O)
D.?4/5(O2)=v(NO)
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列措施或事实能用勒沙特列原理解释的是?
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.钢铁在潮湿的空气中生锈
C.H2、I2、HI平衡混合气加压后颜色变深
D.新制的氯水在光照下颜色变浅
参考答案:D
本题解析:如果改变影响平衡的一个条件,则平衡就向能够减弱这种改变的方向进行,这就是勒夏特例原理,适用于所有的平衡体系,据此可知选项D符合;A中正反应是放热反应,升高温度不利于氨的合成;B中反应不是可逆反应;C中反应前后体积不变,改变压强平衡不移动,颜色加深是由于单质碘的浓度增加引起的,答案选D。
点评:该题是中等难度试题的考查,也是高考中的常见考点。试题基础性强,侧重对学生基础知识的训练和巩固,旨在考查学生灵活运用勒夏特例原理解决实际问题的能力,有利于培养学生的逻辑推理能力和灵活应变能力。
本题难度:一般