| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(二)
参考答案:C 本题解析:A、根据盖斯定律,反应①减反应②,则反应热="-297.16+296.83=-0.33" kJ·mol-1,不选A;B、ΔH3<0,所以反应为放热,不选B;C、放热反应,生成物稳定,所以正交硫稳定,正确,选C;D、反应放热,不选D。 本题难度:一般 2、填空题 (1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ?mo1—1、285.8kJ?mo1—1和393.5kJ?mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。 参考答案:(6分)每空2分。 本题解析:(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=—890.3kJ?mo1—1,②H2(g)+1/2O2(g)=H2O(l) ΔH=—285.8kJ?mo1—1,③C(s)+O2(g)=CO2(g) ΔH=—393.5kJ?mo1—1,根据盖斯定律,由③+②×2—①可得:C(s)+2H2(g)=CH4(g) ΔH=—74.8kJ?mol—1;(2)根据盖斯定律,由①—②可得:2H2O(l)=2H2O(g) ΔH=ΔH2—ΔH1,则H2O(l)=H2O(g) ΔH=(ΔH2—ΔH1)/2;设CO和H2分别为xmol、ymol,则CO放出热量为—ΔH3×xmol/2,H2放出热量为—ΔH1×ymol/2,因此—ΔH3×xmol/2=—ΔH1×ymol/2,则x/y=ΔH1/ΔH3。 本题难度:一般 3、填空题 (3分)下表列出了几种键的键能:
。 参考答案:H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ/mol 本题解析:根据方程式:H2(g)+Cl2(g)=2HCl(g);ΔH =E(反应物)-E(生成物)=436+243-2×431=-183 kJ/mol 本题难度:一般 4、填空题 (16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。 (4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为 。 (5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。 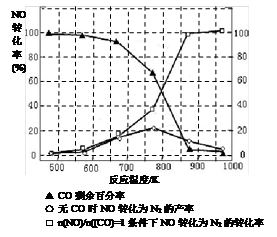 参考答案:(1)(2分)1 (2)(2分)< 本题解析:(1)根据“三段式”进行计算:CO(g)+H2O(g) 本题难度:困难 5、选择题 25℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是 参考答案:B 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《工业合成氨.. | |