1、简答题 有人设计以Pt和Zn为电极材料,埋入人体作某种心脏起搏器的能源。它依靠人体内体液中含有一定物质的量浓度的溶解氧、H+和Zn2+进行工作。试写出两极反应的方程式。
参考答案:负极:2Zn-4e-=2Zn2+?正极:O2+4H++4e-=2H2O
本题解析:题目中给出了Pt、Zn两电极材料。Zn是较活泼的金属,应作负极;Pt不活泼,作正极。又由于电池是利用人体内体液中的溶解氧以及体液中的H+、Zn2+工作,故电极反应应与O2、H+、Zn2+有关,Zn失去电子,O2得到电子。
本题难度:一般
2、计算题 合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 | 甲
| 乙
| 丙
|
反应物投入量
| 3 mol H2、2 mol N2
| 6 mol H2、4mol N2
| 2 mol NH3
|
达到平衡的时间/min
|
| 5
| 8
|
平衡时N2的浓度/mol·L-1
| c1
| 1.5
|
|
NH3的体积分数
| ω1
|
| ω3
|
混合气体密度/g·L-1
| ρ1
| ρ2
|
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步 :2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
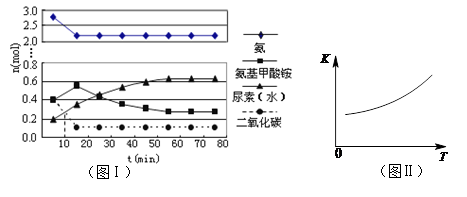
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H ="a" kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2="bkJ·" kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H=" c" kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。

参考答案:(16分)
I.(共8分)(1)0.3 mol·L-1· min-1(2分)[数据正确1分,单位1分]
(2) 或
或 (2分,不写单位不扣分)
(2分,不写单位不扣分)
(3) ab(2分,选1个且正确1分,错1个0分)
II.(共8分)(4)①二(1分,从氨、CO2曲线下降及氨基甲酸铵曲线升高看出第一步是快反应;从尿素曲线升高缓慢看出第二步是慢反应) ②>(1分)
③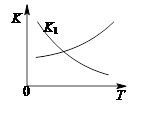 (2分)
(2分)
(5)①NO、NO2(2分,对1个给1分,错1个0分)
② (3c—2a—2b)(2分)
③CO(NH2)2+H2O—6e-=CO2+N2+6H+(2分)
[以下化学方程式或离子方程式:如果2分,化学式1分、系数和条件合起来1分。如果是3分:无条件的方程化学式2分、系数1分;有条件的方程化学式1分、系数1分、条件1分]
答:-1446.6kJ·mol-1答案:CO(NH2)2+H2O—6e-=CO2+N2+6H+
本题解析:(1)先用定义式求v(N2),再用系数之必等于速率之比求v(H2),由于n/V=c,则乙容器中氮气的起始浓度为2mol/L,v(N2)=△c(N2)/△t=(2—1.5)mol/L÷5min=0.1mol/(L?min),由于v(H2)/v(N2)=3/1,则v(H2)=3v(N2)= 0.3mol/(L?min);(2)用三行数据法和定义式求甲容器中反应的平衡常数,则:
3H2(g) + N2(g)  2NH3(g)
2NH3(g)
起始浓度/mol?L-1 1.5 1 0
变化浓度/mol?L-1 3—3c1 1—c1 2—2c1
平衡浓度/mol?L-1 3c1—3 c1 2—2c1 (2分)
K= =
= 或
或 ;
;
(3)对比甲、乙容器,其他条件保持不变时,平衡时将甲容器容积减半,就能变为乙平衡,容积减半可以使氮气、氢气、氨气浓度都立即加倍,增大反应体系的压强,因为合成氨是气体体积缩小的反应,则平衡向正反应方向移动,达到新平衡时氮气的浓度减小,因此2c1 > 1.5,故a选项正确;对比甲、乙容器,由于反应物和生成物都是气体,反应前后气体物质的总质量不变,甲容器中混合气体总质量是乙的一半,两容器容积均为2L,由于混合气体的密度等于质量除以容器容积,则乙容器种混合气体密度是甲的2倍,故b选项正确;对比甲、丙容器可知,其他条件保持不变,丙容器中反应达到平衡后加入1molN2时,所达平衡与甲容器中平衡等效,由于平衡时加入了氮气,增大氮气浓度,使平衡向生成氨气的方向移动,则氨气的体积分数增大,因此甲丙容器中氨气的体积分数不相等,故c选项错误;
(4)①读图,从氨、CO2曲线快速下降及氨基甲酸铵曲线快速升高看出第一步是快反应;从尿素曲线升高缓慢看出第二步是慢反应,因此合成尿素总反应的快慢由第二步反应决定;②读图可知,升高温度,平衡常数K逐渐增大,根据化学平衡移动原理和平衡常数计算表达式可知,前者使平衡向吸热反应方向移动,后者说明平衡向正反应方向移动,则正反应是吸热反应,焓变大于0;依题意,氨气浓度增大,说明第一步反应所达平衡向逆反应方向移动,则第一步反应的平衡常数逐渐减小,由此可以在图II中画出第一步反应的平衡常数K1随温度升高而逐渐减小的曲线;
(5)①观察化学方程式,由于尿素中C、H、O的化合价分别为+4、+1、—2价,各元素化合价代数和为0,则氮元素为—3价,氮元素由尿素中的—3价升为0价,被氧化,则尿素是还原剂,氮元素由NO中的+2价降为0价,NO2中的+4价降为0价,均被还原,则NO、NO2都是该反应的氧化剂;②先将已知热化学方程式编号为①②③,观察发现③×3—①×2—②×2可以约去6H2(g),根据盖斯定律,可以得到热化学方程式:4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H=" (3c—2a—2b)" kJ·mol-1;读图可知,负极主要反应物和产物分别为CO(NH2)2、N2,氮元素由—3价升为0价,根据电子守恒可得:CO(NH2)2—6e-→N2;根据质子交换膜必须用氢离子使左右电荷守恒,则CO(NH2)2—6e-→N2+6H+;根据H、O、C原子个数守恒,则CO(NH2)2+H2O—6e-=CO2+N2+6H+。
考点:考查化学反应原理,涉及平均反应速率的计算、平衡常数的计算、压强和浓度对平衡移动的影响、反应速率和化学平衡图像、氧化剂、盖斯定律、燃料电池负极反应式的书写等。
本题难度:困难
3、填空题 (6分)从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
2FeCl3+Cu=2FeCl2+CuCl2
负极为 ,电极反应方程式为 ,
正极应选 ,电极反应方程式为 。
参考答案:Cu(1分) Cu-2e-=Cu2+ (2分)
C (1分) 2Fe3++2e-=2Fe2+(2分)
本题解析:略
本题难度:一般
4、选择题 (08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H+=2AL3++3H2↑的是(铝条表面的氧化膜均已除去):
 ?
?
参考答案:B
本题解析:本题考查原电池和电解池,较难题。A为原电池,总反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑;C为原电池,总反应为:Al+4H++NO3-=Al3++NO↑+2H2O;D项为电解池,总反应为:2H2O=2H2↑+O2↑。
本题难度:一般
5、填空题 如图所示装置:
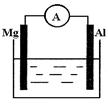
(1)若烧杯中溶液为稀硫酸,则观察到的现象为?。
两极反应式为:正极?;
负极??,该装置将?能转化为?能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为?,
总反应方程式为??。
参考答案:(1)铝的表面有气泡冒出,镁逐渐溶解;2H++2 e-= H2↑;Mg-2 e-=" Mg" 2+?化学?电
(2)铝 2Al+2NaOH+2H2O==NaAlO2+3 H2↑?(2分)(其余每空1分)
本题解析:(1)烧杯中溶液为稀硫酸,则该电池为镁铝原电池,镁有负极,铝为正极,镁极溶解,而铝极析出氢气,所以观察到的现象为铝的表面有气泡冒出,镁逐渐溶解;该原电池中负极发生的反应为:Mg-2 e-=" Mg" 2+?;正极发生的反应为:2H++2 e-= H2↑;该装置是将化学能转化为电能;(2)若烧杯中溶液为氢氧化钠溶液,由于铝为两性物质,所以铝作为负极,而镁有正极,在镁上有氢气析出,而铝极溶解,其总的化学反应方程式为:2Al+2NaOH+2H2O==NaAlO2+3 H2↑。
点评:本题考查了原电池,该考点是高考考查的重点和难点,本题侧重对原电池基础知识的考查,本题难度中等。
本题难度:一般