1、选择题 分别放置在图所示装置(都盛有0.1 mol·L-1的盐酸)中的四个相同的纯锌片,腐蚀最快是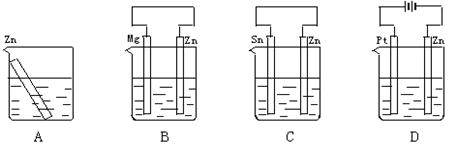
参考答案:C
本题解析:A中锌直接和盐酸发生化学反应,发生氧化反应被腐蚀。B中镁是负极,锌是正极,属于牺牲阳极的阴极保护法。C中锌是负极,锡是正极,通过原电池加速了锌的腐蚀。D中锌和电源的负极相连,作阴极,属于外加电流的阴极保护法。所以答案选C。
本题难度:一般
2、选择题 将铜片和石墨棒用导线相连(其间连有电流表),并同时插入Fe2(SO4)3溶液中,下列现象中不可能出现的是?
[? ]
A.铜片质量减少
B.石墨棒质量增加
C.电流表指针偏转
D.溶液显蓝色
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列各个装置中能组成原电池的是( )
A.

稀硫酸
B.

CuSO4溶液
C.

酒精溶液
D.

? 稀硫酸? 稀硫酸
参考答案:A、两电极的活泼性相同,所以不能构成原电池,故A错误;
B、符合原电池的构成条件,所以能构成原电池,故B正确;
C、酒精是非电解质,该装置不能自发的进行氧化还原反应,所以不能构成原电池,故C错误;
D、该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法正确的是

①Zn是负极? ②电子由Zn经外电路流向Cu
③Zn极的电极反应式是:Zn -2e-=Zn2+? ④Cu2+在溶液中由Cu棒向Zn棒迁移
A.①②
B.①②③
C.②③④
D.①②③④
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,所以选项①②③正确,④不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
5、填空题 (6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。(2分)
(2)写出电极反应方程式
负极 :?
:?
正极:?(各2分)
参考答案:(6分)(1)略?(2)Cu-2e-==Cu2+? 2Fe3++2e-==2Fe2+
本题解析:略
本题难度:一般