1、选择题 室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的一元弱碱的溶液浓度一定比pH=2的一元强酸溶液浓度大
B.浓度均为0.1mol/L的硫酸氢钠溶液与氢氧化钠溶液等体积混合后:c(Na+)=2c(SO42-)=0.2mol?L-1
C.H2C2O4为二元弱酸,浓度为0.1 mol/L的Na2C2O4溶液中: c(Na+) =2c(C2O42-) +c(HC2O4-) + c(H2C2O4)
D.浓度均为0.l mol/L的NaHSO3溶液和NaHCO3溶液中(R表示S或C):c(H+)<c(RO32-)+c(OH-)
参考答案:AD
本题解析:A、弱碱存在电离平衡,则pH=12的一元弱碱的溶液浓度一定比pH=2的一元强酸溶液浓度大,A正确;不、B.浓度均为0.1mol/L的硫酸氢钠溶液与氢氧化钠溶液等体积混合后生成氯酸钠和水,则c(Na+)=2c(SO42-)=0.1mol?L-1,B错误;C.H2C2O4为二元弱酸,浓度为0.1 mol/L的Na2C2O4溶液中根据物料守恒可知: c(Na+) =2c(C2O42-) +2c(HC2O4-) + 2c(H2C2O4),C错误;D、浓度均为0.l mol/L的NaHSO3溶液和NaHCO3溶液中(R表示S或C)根据电荷守恒可知:c(H+)+c(Na+) =2c(RO32-)+c(OH-)+c(HRO3-),根据物料守恒可知c(Na+)=c(RO32-)+c(H2RO3)+c(HRO3-),c(H+)+c(H2RO3)=c(RO32-)+c(OH-),所以c(H+)<c(RO32-)+c(OH-),D正确,答案选D。
考点:考查离子浓度大小比较
本题难度:一般
2、选择题 下列图示与对应的叙述相符的是
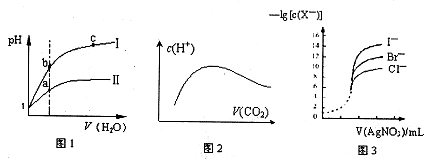
A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系
C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)
D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
参考答案:B
本题解析:A项中,图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释,pH的变化快的曲线是强酸,故曲线I为盐酸,说法错误;B项中,因为酸碱抑制水电离,盐的水解促进水电离,起始的NaOH溶液,水电离的c(H+)小,与CO2反应生成Na2CO3时水解,水电离的c(H+)最大,最后成为饱和的碳酸溶液,水电离出的c(H+)又减小,故图2正确;C项中,图2所示,水电离出c(H+)达到最大值是生成Na2CO3时,溶液中各离子浓度大小分应为c(Na+)>c(CO32-)>c(OH-) >c(HCO3-)>c(H+),故不正确;D项在,用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线可知c(I-)最小,可确定首先沉淀的是I-,说法错误。
本题难度:一般
3、选择题 欲使醋酸溶液中的CH3COO-浓度增大,可加入
[? ]
A、NaOH
B、NaHCO3
C、CH3COOK
D、H2O
参考答案:AC
本题解析:
本题难度:一般
4、选择题 在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
[? ]
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL
D.V总≤20mL
参考答案:AD
本题解析:
本题难度:一般
5、选择题 将标准状况下1.12L氨气溶于500mL水中配制成溶液,从中取出5mL,有关这5mL溶液的叙?述正确的是
A.溶液中c(NH4+)< c(OH—)
B.氨水的物质的量浓度为0.1 mol·L—1
C.溶液的pH>13
D.与5mL 0.1mol·L—1HCl溶液恰好完全中和
参考答案:A
本题解析:A、一水合氨电离出铵根和氢氧根离子,水也可电离出氢氧根离子,故溶液中c(NH4+)< c(OH—) ,正确;B、氨气溶于500 mL水中,不考虑溶液体积的变化时,氨水的物质的量浓度为0.1 mol·L—1,实际上溶液体积不是500 mL,错误;C、氨水是弱电解质,c(OH—)<0.1 mol·L—1,则pH<13,错误;D、氨水的物质的量浓度不等于0.1 mol·L—1与等体积的0.1mol·L—1HCl溶液不是恰好反应,错误。
本题难度:一般