1、选择题 已知反应:3A(g)+B(g)  2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
施是(?)
①增大A的浓度?②升高温度
③增大D的浓度④加入催化剂
⑤恒温下,缩小反应容器的体积
⑥加入稀有气体,保持容器内压强不变
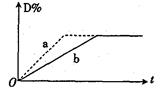
A.①②③
B.④⑤
C.③④⑤
D.④⑤⑥
2、选择题 某温度下,可逆反应m A(g) +n B(g) 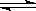 ?p C(g)的平衡常数为K,下列对K的说法正确的是
?p C(g)的平衡常数为K,下列对K的说法正确的是
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n==p,则K=1
3、填空题 (6分)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为?;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为?;
A.2 s? B.3 s? C.4 s? D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是?;
A.v(H2)=0.1 mol·L-1·min-1? B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min- D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g)?△H<0。下列各项能说明该反应已经达到平衡状态的是?? 。
2NH3(g)?△H<0。下列各项能说明该反应已经达到平衡状态的是?? 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
4、选择题 在800℃时,下列可逆反应达到化学平衡状态:CO(g)+H2O(g)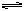 CO2(g)+H2(g),已知CO和H2O(g)的初始浓度为0.01mol·L-1时,H2平衡浓度为0.005mol·L-1。若此时再加入0.02mol·L-1的H2O(g),重新达到平衡时,H2平衡浓度为?
CO2(g)+H2(g),已知CO和H2O(g)的初始浓度为0.01mol·L-1时,H2平衡浓度为0.005mol·L-1。若此时再加入0.02mol·L-1的H2O(g),重新达到平衡时,H2平衡浓度为?
A.0.0025 mol·L-1
B.0.0075 mol·L-1
C.0.010 mol·L-1
D.0.015 mol·L-1
5、选择题 在恒温条件下,一定体积的容器中放入3L气体R和2L气体Q,在一定条件下发生反应:4R(g)+3Q(g) 
 ?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
?2X(g) +nY(g),反应达平衡后,容器内温度不变,混合气体的压强比原来减小了,则反应中方程式的n值是
A.4
B.5
C.6
D.7