1、填空题 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___MnO4-+___Fe2++____H+=_____Mn2++____Fe3++_____H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为____g。
(4)混合物中Cu2S的质量分数为________。
参考答案:(1)1、5、8、1、5、4
(2)0.007
(3)19.6
(4)40%
本题解析:
本题难度:一般
2、填空题 同位素示踪法是用同位素作为一种标记,制成含有同位素的标记化合物代替相应的
非标记化合物进行化学反应,然后用核探测器随时追踪它在反应产物中的存在形式来确定反应的原理等。
氧化还原反应氧化剂与还原产物、还原剂与氧化产物之间的内在关系也可以利用同位素失踪法进行验证。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),
反应完成后含有示踪原子的物质是________________。
(2)K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为KClO3+6HCl(浓)= KCl+3Cl2↑+
3H2O,此反应生成氯气的摩尔质量为________________。
(3)某反应体系中共有6种物质,KClO3、KCl、HCl、Cl2、ClO2、H2O,请你设计同位素失踪法确定反应
的方程式并配平:?
参考答案:O2;73.3g.mol-1;2K37ClO3+4HCl= 2KCl+Cl2+237ClO2+2H2O
本题解析:(1)该反应中,H2O2是还原剂,被酸化的KMnO4溶液氧化,化合价升高,生成O2,所以18O存在于O2中。(2)由分析可知,生成的3个Cl2中6个Cl有5个来自于HCl中的37Cl,有1个来自于KClO3中的35Cl,故氯气的分子量为(35+5×37)÷5×2=73.3g,则氯气的摩尔质量为73.3g.mol-1
(3)可以用37Cl跟踪反应,该反应中Cl元素化合价有+5、+4、0、—1四种,显然氯元素最高价和最低
价分别为氧化剂和还原剂,根据同种元素之间发生氧化还原反应化合价“只靠拢、不相交”的原则,如果
用含有同位素37Cl的K37ClO3参加反应,则还原产物为37ClO2,配平方程式得:2K37ClO3+4HCl=
2KCl+Cl2+237ClO2+2H2O。
本题难度:简单
3、选择题 金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC aTiCl4+cCO……反应①
aTiCl4+cCO……反应①
TiCl4+2Mg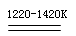 Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
关于反应①②的分析不正确的是(? )
A.TiCl4在反应①中是还原产物,在反应②中是氧化剂
B.C、Mg在反应中均为还原剂,被氧化
C.每生成0.4 mol Ti,反应①②中共转移3.2 mol e-
D.反应①②都是置换反应
参考答案:D
本题解析:选项A,在反应①中TiCl4为还原产物,Cl2为氧化剂,在反应②中,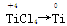 ,故TiCl4是氧化剂。选项B,还原剂被氧化。选项C,每生成0.4 mol Ti,反应①②中转移电子均为1.6 mol,共3.2 mol e-。选项D,反应①不是置换反应。
,故TiCl4是氧化剂。选项B,还原剂被氧化。选项C,每生成0.4 mol Ti,反应①②中转移电子均为1.6 mol,共3.2 mol e-。选项D,反应①不是置换反应。
本题难度:一般
4、填空题 实验室制取氯气时,若没有MnO2则用KMnO4代替,据此回答下列问题:
(1)配平该反应

(2)被氧化的HCl与未被氧化的HCl的物质的量之比为
参考答案:(1)、2;16;2;2;5;6 (2分)
(2) 5:3 (3分)
本题解析:略
本题难度:一般
5、选择题 实现下列变化,一定要加入氧化剂的是
A.HCl→Cl2
B.Na2SO3→SO2
C.HCl→H2
D.HNO3→NO
参考答案:A
本题解析:说明选项中物质被氧化,其元素化合价将升高,只有A项符合题意
本题难度:简单