1、选择题 RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
A.R3O4,RO,2 :1
B.RO2,RO, 1:3
C.RO2,R3O4 ,1 : 2
D.RO2,RO,1 : 4
2、填空题 (12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=?,R元素在
+6I—+6H+=R—+3I2+3H2O,n=?,R元素在 中的化合价是?。
中的化合价是?。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
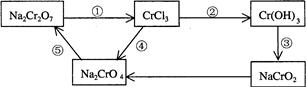
①?在上述有编号的步骤中,需用氧化剂的是?(填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是?。
3、填空题 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-= NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________。
(2)反应中硝酸体现了___________、___________(填化学性质)。
(3)反应中若产生了0.2 mol气体,则转移电子的物质的量是________mol。
4、选择题 下列描述的物质一定是金属单质的是?
A.能失去电子的物质
B.能得到电子的物质
C.由含11个质子的原子构成的物质
D.能与水反应的物质
5、填空题 MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是?。
(2)用MnO2制KMnO4的工艺流程如图

电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式??,投料时必须满足n(KOH):n(MnO2) ?。
②阳极的电极反应为?。
③B物质是?(写化学式,下同),可以循环使用的物质是?。
④钾离子交换膜的一种材料是聚丙烯酸钾(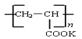 ),聚丙烯酸钾单体的结构简式为?。
),聚丙烯酸钾单体的结构简式为?。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是?(精确到0.1%)。