1、选择题 RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
A.R3O4,RO,2 :1
B.RO2,RO, 1:3
C.RO2,R3O4 ,1 : 2
D.RO2,RO,1 : 4
参考答案:B
本题解析:根据题意,1 mol RO2最终生成RO,设氧化反应生成O2的物质的量为3a,则生成的Cl2的物质的量为2a,根据氧化还原反应得失电子守恒,可得2=3a×4+2a×2,解得a=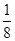 mol,则氧化Cl-的RO2的物质的量为
mol,则氧化Cl-的RO2的物质的量为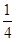 mol,即产物中+4价的R为
mol,即产物中+4价的R为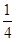 mol,综合四个选项,只有B符合要求。
mol,综合四个选项,只有B符合要求。
本题难度:一般
2、填空题 (12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=?,R元素在
+6I—+6H+=R—+3I2+3H2O,n=?,R元素在 中的化合价是?。
中的化合价是?。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
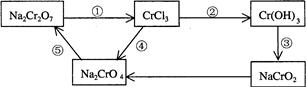
①?在上述有编号的步骤中,需用氧化剂的是?(填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是?。
参考答案:(12分)
( 1?)n=1?(2分)+5。?(2分)
( 2?)①?④?(2分)
② 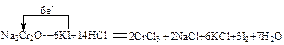 ( 4分)?381g?( 2分)
( 4分)?381g?( 2分)
本题解析:略
本题难度:一般
3、填空题 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-= NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________。
(2)反应中硝酸体现了___________、___________(填化学性质)。
(3)反应中若产生了0.2 mol气体,则转移电子的物质的量是________mol。
参考答案:(1)14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O
(2)酸性;氧化性
(3)0.6
本题解析:
本题难度:一般
4、选择题 下列描述的物质一定是金属单质的是?
A.能失去电子的物质
B.能得到电子的物质
C.由含11个质子的原子构成的物质
D.能与水反应的物质
参考答案:C
本题解析:A.能失去电子的物质是还原剂,如Fe2+,不是金属单质;B.能得到电子的物质一定不是金属单质,金属单质只能失去电子; C.由含11个质子的原子构成的物质是金属Na,正确;D.能与水反应的物质有Na2O等,不是金属单质。
本题难度:一般
5、填空题 MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是?。
(2)用MnO2制KMnO4的工艺流程如图

电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式??,投料时必须满足n(KOH):n(MnO2) ?。
②阳极的电极反应为?。
③B物质是?(写化学式,下同),可以循环使用的物质是?。
④钾离子交换膜的一种材料是聚丙烯酸钾(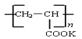 ),聚丙烯酸钾单体的结构简式为?。
),聚丙烯酸钾单体的结构简式为?。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是?(精确到0.1%)。
参考答案:(1)MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O
(2)①2MnO2 + O2 + 4KOH ?2K2MnO4 + 2H2O?,大于(或 >)2 : 1
?2K2MnO4 + 2H2O?,大于(或 >)2 : 1
②?MnO42- - e- = MnO4-?③?H2,KOH固体?④?CH2="CHCOOK" ?⑤?95.8%
本题解析:(1)根据题意,结合电荷守恒、原子守恒、电子守恒,可得方程式为:MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O。(2)①在240℃熔融时MnO2、O2、KOH发生氧化还原反应,根据质量守恒定律和电子守恒的知识可知发生该反应的化学方程式为:2MnO2 + O2 + 4KOH? ?2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
?2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
本题难度:一般