1、填空题 (14分)碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)用CO2 和H2 合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知: +
+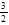
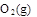 =
= 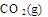 ?+ 2
?+ 2 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-1
2H2 (g)+O2(g) = 2H2O(l)?△H = -565.6 kJ·mol-1,
请写出工业上用CO2 和H2 合成CH3OH(l)的热化学方程式:?;
(2)一种新型燃料电池,一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则在该熔融电解质中,O2-向?(填“正”或“负”)极移动,电池负极电极反应为:? ?;
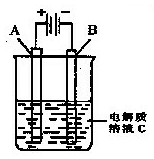
(3)如图是一个电化学装置示意图。用CH3OH-空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是CuSO4溶液,通电一段时间后,向所得溶液中加入8 g CuO固体后恰好可使溶液恢复到电解前的浓度和pH.则电解过程中收集到标准状况下的气体体积为?;
(4)常温下0.01 mol·L-1的氨水中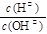 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为?;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1??V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为?;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1??V2(填“>”、“<”或“=”)。
参考答案:(1)CO2(g) + 3H2(g)=CH3OH(l) + H2O(l)?△H=-122.9 kJ·mol-1(2分)
(2)负(2分),CH3OH-6e-+3O2-=CO2 + 2H2O(2分)
(3)1.12 L(2分)
(4)10,10-4 mol·L-1 ; >?(每空2分)
本题解析:(1)写出反应方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l),再根据盖斯定律有目标方程式等于②×-①,故ΔH=×(-565.5)-(725.5)=-122.75 KJ/mol;(2)在原电池中阳离子向正极移动,阴离子向负极移动,燃料做负极,故负极反应为:CH3OH-6e-+3O2-=CO2 + 2H2O;(3)电解后加入CuO能恢复到原来状态,说明生成物为Cu和O2,8gCuO为0.1mol,故生成0.05mol氧气,标况下体积为1.12L;(4)===10-6,故c(H+)=10-10mol/L,pH=10,c(HCl)<c(NH3·H2O),现要呈中性,故有V1>V2。
本题难度:一般
2、填空题 由铜、锌和稀硫酸组成的原电池中,正极材料是______,负极发生的电极反应是_________________总的电池反应式(离子方程式)是___________________。当导线中有1 mol电子通过时,理论上两极的变化是________________________(填序号)。
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出l g H2 ④铜片上析1molH2
参考答案:铜;Zn - 2e- = Zn2+ ;Zn + 2H+ = Zn2+ + H2 ;①③
本题解析:
本题难度:一般
3、简答题 如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
(1)写出A、B两池中阳极电极反应式
(2)计算标准状况下气体各为多少升?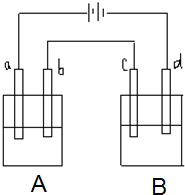
参考答案:(1)该装置是电解池,电解池工作时,A装置阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑
;B装置中阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑.
答:A、B两池中阳极电极反应式分别为2Cl--2e-═Cl2↑;4OH--4e-═2H2O+O2↑;
(2)通电一段时间后,B池中阴极增重0.64g,则转移电子的物质的量=0.64g64g/mol×2=0.02mol;则生成氯气的体积=
0.02mol2×22.4L/mol=224mL,则生成氧气的体积=0.02mol4×22.4L/mol=112mL.
答:标准状况下V(Cl2)=224mL;?V(O2)=112mL.
本题解析:
本题难度:一般
4、选择题 下列化学电池中,属于绿色电池的是
A.铅蓄电池
B.锌锰电池
C.镍镉电池
D.氢氧燃料电池
参考答案:D
本题解析:选项A、B、C中都含有重金属元素,会造成环境的污染。燃料电池产物对环境无污染,属于绿色电池,答案选D。
本题难度:简单
5、选择题 将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
A.电子由锌片经导线流向铜片
B.铜片作正极,锌片作负极
C.溶液中SO42- 的物质的量浓度保持不变
D.溶液中Cu2+移向负极
参考答案:D
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子在正极得到电子,所以选项A、B、C都是正确的,D不正确,溶液中Cu2+移向正极,答案选D。
点评:该题高考中的常见考点,属于基础性试题的考查,难度不大。重点考查学生对原电池原理,特别是电极名称和电极反应式书写的了解掌握情况,意在培养学生的逻辑推理能力。明确原电池的工作原理是答题的关键。
本题难度:一般