1、填空题 在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q?kJ/mol?CO和H2O浓度变化如图,则
(1)0-4min的平均反应速率v(CO)=______mol/(L?min)
(2)下列能说明反应达到平衡状态的是______.
a、每消耗1mol?CO2的同时生成l?molH2O?b、体系压强保持不变
c、v正(CO)=v逆(CO2)?d、容器中混合气体的密度保持不变
e、混合气体中H2O的体积分数保持不变?f、CO2和H2的体积比保持不变
t1℃时物质浓度(mol/L)的变化
| 时间 | CO | H2O | CO2 | H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
C1
C2
C3
C3
4
C1
C2
C3
C3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
|
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min-4min之间反应处于______状态;C1数值______0.08mol/L(填大于、小于或等于).
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气?b.降低温度
c.使用催化剂?d.增加氢气浓度.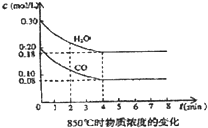
参考答案:(1)v(CO)=△C△t=(0.20-0.08)mol/L4min=0.03mol/L.min,故答案为:0.03mol/L.min;
(2)a、无论反应是否达到平衡状态,每消耗1mol?CO2的同时生成l?molH2O,所以不能作为判断平衡的依据,故错误;
b、该反应是一个反应前后气体体积不变的可逆反应,无论反应是否达到平衡状态,体系压强始终保持不变,所以不能作为判断平衡的依据,故错误;
c、当v正(CO)=v逆(CO2)时,该反应达到平衡状态,所以可以作为判断平衡的依据,故正确;?
d、反应前后气体的质量不变,容器的体积不变,所以气体的密度始终不变,所以容器中混合气体的密度保持不变不能作为判断平衡的依据,故错误;
e、反应达到平衡状态时,各物质的体积不变,所以混合气体中H2O的体积分数保持不变可以作为判断平衡的依据,故正确;
f、无论反应是否达到平衡状态,CO2和H2的体积比可能都保持不变,这与反应起始浓度和转化率有关,所以不能作为判断平衡的依据,故错误;
故选ce;
(3)①3min、4min时,各物质的物质的量浓度不变,所以该反应达到平衡状态;
该CO(g)+H2O(g)?CO2(g)+H2(g)反应是放热反应,升高温度,平衡向逆反应方向移动,所以t℃(高于850℃)时,C1数值大于850℃CO的浓度,所以C1>0.08mol/L,
故答案为:平衡;>;
②C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度;
5min-6min之间,一氧化碳浓度减小,水蒸气和二氧化碳浓度增大,平衡向正反应方向移动,则改变的条件是增大水蒸气的浓度;
故答案为:d;a.
本题解析:
本题难度:一般
2、选择题 在一定温度下发生可逆反应A(g)+3B(g)?2C(g),下列叙述中,不能判断该反应达到平衡的是( )
A.C生成速率与C分解速率相等
B.单位时间内生成amolA,同时生成3amolB
C.A、B、C的浓度不再变化
D.单位时间内消耗amolA,同时生成3amolB
参考答案:A.物质C生成速率表示V正,C分解速率表示V逆,当C的生成速率与C分解的速率相等,该反应达到平衡状态,能判断该反应达到平衡,故A不选;
B.单位时间内生成amolA,同时生成3amolB都是逆反应速率,无法判断正逆反应速率相等,不能判断该反应达到平衡,故B选;
C.容器中各组分浓度不再变化,正逆反应速率相等,达到了平衡状态,能判断该反应达到平衡,故C不选;
D.消耗A表示V正,生成B表示V逆,单位时间内A的消耗速率与B的生成速率之比为1:3时,该反应达到平衡状态,能判断该反应达到平衡,故D不选;
故选B.
本题解析:
本题难度:简单
3、填空题 工业上合成氨的反应是:N2(g)+3H2(g)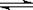 2NH3(g)? ΔH=-92.20 kJ·mol-1。
2NH3(g)? ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________?
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| N2
| 1.00
| 1.00
|
根据表中数据计算:
①反应进行到2小时时放出的热量为________?
②0~1小时内N2的平均反应速率________ mol·L-1·h-1;
③此条件下该反应的化学平衡常数K="?" ________?(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________?方向移动(填“正反应”或“逆反应”、“不移动”)。
参考答案:
本题解析:略
本题难度:一般
4、选择题 在一固定容积的密闭容器中进行如下反应:2SO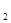 (g)+O
(g)+O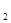 (g)
(g)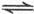 2SO
2SO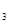 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO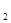 、O
、O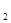 、SO
、SO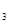 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O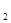 表示该反应的平均反应速率为0.01 mol/(L·s)
表示该反应的平均反应速率为0.01 mol/(L·s)
B.当反应达平衡时,SO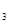 的物质的量可能为0.4 mol
的物质的量可能为0.4 mol
C.当SO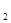 和O
和O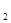 的生成速率之比为2:1时,达到该反应限度
的生成速率之比为2:1时,达到该反应限度
D.向容器内充人SO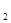 ,可以提高反应速率
,可以提高反应速率
参考答案:D
本题解析:反应进行到10s时生成三氧化硫0.2mol,则消耗氧气是0.1mol。由于不能确定容器的体积,所以不能计算该反应的反应速率是,A不正确;根据S原子守恒可知,SO2和SO3的物质的量之和是0.4mol,由于反应是可逆反应,反应物的转化率达不到100%,所以当反应达平衡时,SO3的物质的量不可能为0.4 mol,B不正确;反应速率之比是相应的化学计量数之比,所以二氧化硫和氧气的反应速率总是2:1的,C不正确;向容器内充人SO2,增大SO2的浓度,可以提高反应速率,D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,贴近高考,注重答题的灵活性,有利于培养学生的逻辑推理能力和抽象思维能力。易错点是选项A。
本题难度:一般
5、选择题 一定温度下,在固定容积的密闭容器中,可逆反应mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态一定能说明反应已达到平衡的是( )
①体系的压强不再发生变化②体系的密度不再发生变化
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率VA:VB:VC:VD=m:n:p:q.
A.只有③④
B.②③④
C.①②③④
D.①②③④⑤
参考答案:①如果该反应是一个反应前后气体体积不变的可逆反应,则体系的压强始终不变,所以不能根据压强判断反应是否达到平衡状态,故错误;
②反应前后混合气体的质量不变,容器的体积不变,所以体系的密度始终不变,所以不能据此判断该反应是否达到平衡状态,故错误;
③各组分的物质的量浓度不再改变,该反应达到平衡状态,故正确;
④反应到达平衡状态时各组分的物质的量不再改变,各组分的质量分数不再改变,故正确;
⑤反应速率之比等于计量数之比反应后任何时刻都正确,属于当反应速率vA:vB:vC:vD=m:n:p:q,不能据此判断该反应是否达到平衡状态,故错误;
所以只有③④正确;
故选:A.
本题解析:
本题难度:简单