1、选择题 可以证明可逆反应N2(g)+3H2(g)?2NH3(g)已达平衡状态的是( )
①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的总质量不变;④恒温恒容下的反应,体系压强不再改变;⑤反应体系中反应物和生成物的百分含量都不再改变;⑥恒温恒压下的反应,密度不再改变;⑦正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=0.4mol/(L?min)
A.全部
B.②④⑤⑥⑦
C.②③④⑤⑥⑦
D.③④⑤⑥⑦
参考答案:①无论是否达到平衡状态,只要一个N≡N断裂的同时,就有3个H-H键断裂,所以不能证明该反应达到平衡状态,故错误;
②只要一个N≡N键断裂同时就要形成6个N-H,而已知又有6个N-H键断裂,说明N-H断裂和形成的数目相同,即NH3的物质的量保持不变,所以能证明该反应达到平衡状态,故正确;
③根据质量守恒,不论反应是否达到平衡状态,气体混合物的都质量不变,所以不能证明该反应达到平衡状态,故错误;
④该反应是一个气体体积改变的反应,当反应达到平衡状态时,各物质的浓度不变,则其压强也不变,所以保持其他条件不变时,体系压强不再改变,能说明该反应达到平衡状态,故正确;
⑤反应达到平衡状态时,各物质的百分含量不变,所以反应物和生成物的百分含量都不再改变,能证明说明该反应达到平衡状态,故正确;
⑥恒温恒压时,气体物质的量减少,体积减小,密度增大,所以能证明该反应达到平衡状态,故正确;
⑦v正(H2)表示消耗H2的速率,v逆(NH3)表示消耗NH3的速率,且v正(H2):v逆(NH3)=3:2,充分说明向两个相反方向进行的程度相当,说明到达平衡状态,故正确;故②④⑤⑥⑦正确;
故选B.
本题解析:
本题难度:简单
2、选择题 一定温度下的反应A(g)+3B(g)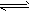 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
[? ]
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内a mol A生成,同时生成3a mol B
D.C的生成速率与C的分解速率相等
参考答案:C
本题解析:
本题难度:一般
3、选择题 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v逆(NH3)=3v正(H2O)
参考答案:A
本题解析:根据反应速率之比是相应的化学计量数之比可知,A正确,D不正确;B中反应速率的方向是相同的,所以不能说明;增大容器的容积,压强降低,正逆反应速率均是降低的,C不正确,答案选A。
本题难度:简单
4、选择题 在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应物浓度:a点小于c点
B.c点时反应进行的程度最大
C.该反应的正反应为吸热反应
D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段
参考答案:D
本题解析:反应起始时反应物浓度大,因此反应物浓度:a点大于c点,A项错;c点反应速率最大,反应不一定处于平衡态,而反应进行程度最大是指反应达到平衡态,B项错;反应起始阶段,反应物浓度减少而反应速率加快,只能是温度升高导致,再结合容器不导热可知正反应为放热反应,C项错;反应速率a~b小于b~c,故等同时间内,生成H2的量,a~b段小于b~c段,D项正确。
本题难度:一般
5、选择题 一定温度下,密闭容器中可逆反应3X(g)+Y(g)?2Z(g)达到限度的标志是( )
A.X的生成速率与Z的生成速率相等
B.单位时间内生成3nmolX,同时消耗nmolY
C.某时刻X、Y、Z的浓度相等
D.某时刻X、Y、Z的分子个数比为3:1:2
参考答案:A、正逆反应速率相等指同一种物质的正逆反应速率相等,故A错误;
B、单位时间内生成3nmolX时也生成nmolY,同时消耗nmolY,所以Y的正逆反应速率相等,故B正确;
C、浓度与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;
D、达平衡时,X、Y、Z三种物质的分子数之比可能是3:1:2,也可能不是3:1:2,这要看反应开始时加入的A、B、C三种物质是否按3:1:2比例而定,故D错误;
故选B.
本题解析:
本题难度:一般