1、实验题 用铜片、锌片和200mL稀H2SO4等组成原电池(如右图)。若整个实验过程有6.5 g锌溶解,此时H2SO4恰好全部用完。回答下列问题:
写出正极的电极反应式 ,正极发生的现象是 ,负极的电极反应式为 。
(2)试计算:铜片上共放出 L气体(标准状况),整个实验过程转移电子 mol,稀硫酸的物质的量浓度为 mol/L。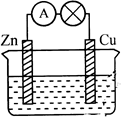
参考答案:

本题解析:略
本题难度:一般
2、填空题 现有如下两个反应:
A.NaOH+HCl NaCl+H2O
NaCl+H2O
B.2FeCl3+Cu 2FeCl2+CuCl2
2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:
A. ,B. (填“能”或“不能”);?
(2)如果不能,说明其原因? ;?
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液名称:
负极材料 ? ,电极反应式 ?电解质溶液名称 ,正极材料 ,电极反应式?? ?。
参考答案:(10分) (1)不能;能? (2) A反应是非氧化还原反应
(3)铜;Cu- 2e-= Cu2+ ;氯化铁溶液;碳、铂、银;2Fe3+ + 2e-=2 Fe2+
本题解析:原电池中有电子的定向运动,所以只有氧化还原反应才能设计成原电池。A是中和反应,不是氧化还原反应,不能设计成原电池。B是氧化还原反应,可以设计成原电池。由于原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以根据B中放热方程式可知,铜是还原剂,则铜作负极,正极的材料可以是碳或铂或银。铁离子得到电子,所以电解质容易应该是含有铁离子的可溶性盐溶液,因此可以性质氯化铁。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,有利于调动学生的学习兴趣,激发学生的学习积极性和创造性。该题的关键是明确原电池的工作原理,并能灵活运用即可。
本题难度:一般
3、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
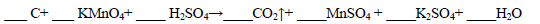
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
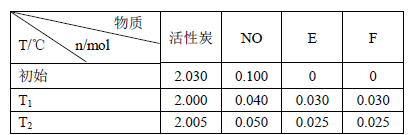
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
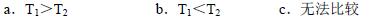
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: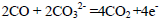 则
则
正极反应式:___ ,电池总反应式 。
参考答案:(1)5、4、6、5、4、2、6(2)C(s)+H2O(g)=CO(g)+H2(g),ΔH=+131.6 kJ?mol—1(3)①Ⅰ.0.5625 Ⅱ.c(4)c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(5)O2 +2CO2+4e-=2CO32-, 2CO+O2=2CO2
本题解析:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由于产物中有Cr2(SO4)3,所以未知的反应物为H2SO4,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4
本题难度:困难
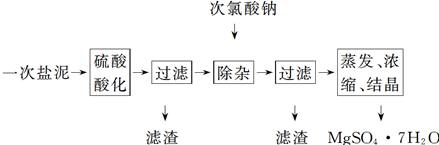
4、填空题 MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
 ?
?
(1)用硫酸调整溶液pH为1~2,硫酸的作用是________________________________________。
(2)加次氯酸钠溶液至pH为5~6并加热煮沸约5~10 min,滤渣中主要含MnO2和另两种沉淀:__________________、____________(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为________________________?___
(3)若除杂后过滤,发现滤液发黄,需采取的措施是____?____
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是________________________________________
(5)晶体中结晶水含量的测定:准确称取0.20 g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚中,置于马沸炉中,在200 ℃脱水1 h。为准确确定脱水后的质量,还需要经过的操作有冷却(干燥器中)至室温→__________?_________________
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50 g,用200 mL水溶解,加入2 mol·L-1 HCl溶液5 mL,将溶液加热至沸腾,在不断搅拌下逐滴加入5~6 mL 0.5 mol/L BaCl2溶液,充分沉淀后,得沉淀0.466 g,则样品中w(SO42-)=________________。
(7)已知:Na2CO3·10H2O (s)=Na2CO3(s)+10H2O(g)?ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)?ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式__?__________。
参考答案:(1)浸出Mg、Fe、Al、Mn离子,除去Si、Ca;
(2)Al(OH)3、Fe(OH)3;Mn2++2OH一+C1O一=MnO2↓+Cl一+H2O;
(3)添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)减小硫酸镁的溶解损耗,并快速干燥;
(5)称量后重复脱水→冷却→称量至恒重;
(6)38.4%;
(7)Na2CO3?H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73KJ/mol
(评分标准:除(2)前2空各1分,其余每空2分,方程式若有漏写“↑”“↓”或者反应条件未写,均扣1分;若配平有误,扣2分,共16分)
本题解析:(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸(SiOrnH2O)沉淀,钙盐转化为硫酸钙沉淀而除去,
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤
(4)用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,
(5)重复脱水后至恒重说明已经完全脱水
(6)m(SO42-)=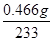 ××96=0.192g,w(SO42-)=
××96=0.192g,w(SO42-)=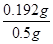 =38.4%,
=38.4%,
本题难度:一般
5、选择题 如图所示,电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别为
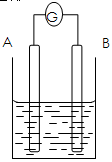
A. A是Zn,B是Cu,C是稀硫酸? B. A是Cu,B是Zn,C是稀硫酸
C. A是Fe,B是Ag,C是稀AgNO3溶液? D. A是Ag,B是Fe,C是稀AgNO3溶液
参考答案:D
本题解析:由题意电流表G发生偏转,说明形成了电流,该装置为原电池装置,又A极质量增加,B极质量减少,即可得B电极为负极,A电极为正极;在原电池中通常负极的活动性比正极的活动性强,且负极能与电解质溶液发生自发的氧化还原反应。
A错,该原电池装置中A极质量减少,B极质量不变;
B错,该原电池装置中A极质量不变,B极质量减少;
C错,该原电池装置中A极质量减少,B极质量增加;
D正确,其电极反应式为:A极(正极):2Ag++2e—= 2Ag,A极质量增加;B极(负极):Fe—2e—= Fe2+;B极质量减少;
本题难度:简单