1、推断题 X、Y、Z、W均为短周期元素组成的物质,它们之间有如图所示转化关系
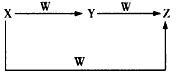
请你从所学的知识出发,归纳出四组符合上述要求的 X、Y、Z、W的组合。

参考答案: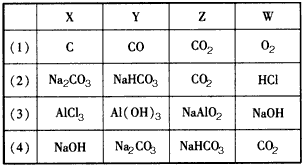
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出):
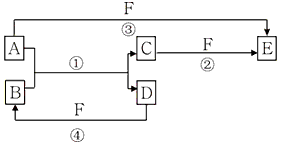
(1)若A、D、F都是短周期非金属元素单质,且A、D常温下为固态单质,所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________________________;B固体的晶体类型属于__________晶体。写出E的结构式_________。
(2)若A是常见的金属单质,常温下D、F是气态单质,反应①和②均在水溶液中进行。用离子方程式解释E的水溶液显酸性原因____________________________,D与F在一定条件下反应生成B的化学方程式为_____________________________。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成(部分产物框图中未给出),则A的原子结构示意图为
_________,D在周期表中位置______________,反应①的化学方程式为_________________________。
参考答案:(1)2C+SiO2=Si+2CO;原子晶体;O=C=O
(2)Fe3++3H2O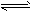 Fe(OH)3+3H+;H2+Cl2
Fe(OH)3+3H+;H2+Cl2 2HCl (3)
2HCl (3)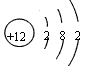 ;第二周期第ⅣA族;2Mg+CO2
;第二周期第ⅣA族;2Mg+CO2 2MgO+C
2MgO+C
本题解析:
本题难度:一般
3、简答题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:

(1)A元素的原子结构示意图为______.
(2)写出下列物质的化学式:E是______,K是______.
(3)化合物B属于______化合物(填“离子”或“共价”).
(4)实验室检验J中所含的金属离子时,常在J的溶液中加入______溶液.
(5)写出反应“F→G”的化学方程式:______;
(6)写出反应“I→J”的离子方程式:______.
参考答案:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为

,
故答案为:

;
(2)由以上分析可知E为Cl2,K为Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(3)B为HCl,为共价化合物,故答案为:共价;
(4)J为FeCl3,加入硫氰化钾发生颜色反应,溶液呈红色,加入氢氧化钠溶液,生成氢氧化铁红褐色沉淀,
故答案为:硫氰化钾溶液或氢氧化钠溶液;
(5)F为Al(OH)3,G为NaAlO2,反应“F→G”的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)I为FeCl2,J为FeCl3,反应“I→J”的离子方程式为2Fe2++Cl2=2Fe2++2Cl-,
故答案为:2Fe2++Cl2=2Fe2++2Cl-.
本题解析:
本题难度:一般
4、推断题 X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素。其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1∶2。另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化
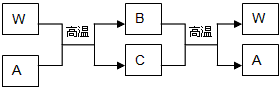
请完成下列问题:
(1)X、Y、Z三种元素的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为__________(用氢化物的分子式表示)。
(3)Y元素最高价氧化物对应水化物的电子式为________________________。
(4)W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)_____________________。
(5)B为黑色固体,在上述变化中,生成1molB转移电子_________________mol。
(6)以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为_________,电池总反应为________________________。
参考答案:(1)Cl- F- Na+
(2)H2O、HF、HCl
(3)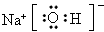
(4)Fe3++3SCN-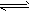 Fe(SCN)3(或Fe3++3OH-=Fe(OH)3↓)(其它合理答案亦可)
Fe(SCN)3(或Fe3++3OH-=Fe(OH)3↓)(其它合理答案亦可)
(5)8
(6)石墨或铜;Fe+2Fe3+=3Fe2+(或Fe+2FeCl3=3FeCl2)
本题解析:
本题难度:困难
5、简答题 如图所示:①~⑩分别代表有关反应中的一种物质,它们均为常见物质.已知①~⑤和⑥~⑩中分别含有同一种元素.试回答下列问题:

(1)写出指定物质的化学式:④______;⑥______
(2)写出反应(Ⅲ)的化学方程式______指出该反应的重要用途之一:______
(3)写出反应(Ⅰ)的离子方程式______
(4)反应(Ⅳ)的主要实验现象是______该反应的化学方程式为:______.
参考答案:①与强碱、强酸都反应,则①为铝或氧化铝或氢氧化铝或弱酸的铵盐等,②、③反应生成沉淀,则②是偏铝酸盐,③是铝盐,偏铝酸盐和铝盐反应生成白色沉淀氢氧化铝,则④是氢氧化铝,加热氢氧化铝生成氧化铝和水,①~⑤中含有同一种元素,所以⑤是氧化铝,电解氧化铝生成铝和氧气,所以①是铝;
红棕色粉末⑥是氧化铁,铝和⑦反应生成氧化铁和铝,根据铝热反应知,⑦是铁,铁和弱氧化性酸反应生成亚铁盐⑧,亚铁盐和氢氧根离子反应生成氢氧化亚铁⑨,氢氧化亚铁和氧气、水反应生成氢氧化铁⑩.
(1)通过以上分析知,④是Al(OH)3,⑥是Fe2O3;
故答案为:Al(OH)3,Fe2O3;
(2)铝和氧化铁发生铝热反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3??△?.??2Fe+Al2O3,铝热反应可用于焊接钢轨;
故答案为:2Al+Fe2O3??△?.??2Fe+Al2O3,焊接钢轨(或定向爆破)
(3)铝和强碱溶液反应生成偏铝酸盐和氢气,
离子方程式为:2Al+2OH-+2H2O═AlO2-+3H2↑或2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
故答案为:2Al+2OH-+2H2O═AlO2-+3H2↑或2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
(4)氢氧化亚铁是白色沉淀,氢氧化亚铁不稳定,会迅速变成灰绿色,最终变成红褐色氢氧化铁沉淀,所以实验现象是:白色沉淀迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色,4Fe(OH)2+O2+2H2O═4Fe(OH)3.
本题解析:
本题难度:一般