1、推断题 A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系
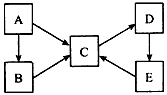
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列反应的离子方程式:
①B→C_____________。 ②C→D_______________。 ③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。
①A的电子式为__________。
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。
④将足量的A投入FeCl2溶液中充分反应,有无色无味的气体生成,且A与气体的物质的量之比为4:1,写出上述反应的离子方程式________________。
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/LE溶液中只有3种离子,且常温下溶液中的
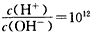 。
。
?①B的电子式为__________。
②B→C的化学方程式为:______________。
③A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式:____________________
2、推断题 图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
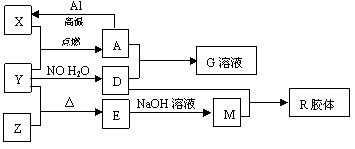
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是__________;M中存在的化学键类型为__________;R的化学式是__________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为__________。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:__________________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:____________________。
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出
n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。

3、简答题 A、B、C、D、E为原子序数依次增大的五种短周期元素.E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y.
(1)写出E元素和钾元素形成的化合物的化学式______.
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为______.
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为______.
(4)生成白色沉淀Y的离子方程式为______.
(5)在1molD的最高价氧化物形成的晶体中,含有共价键______mol.
4、简答题 已知有以下物质相互转化:
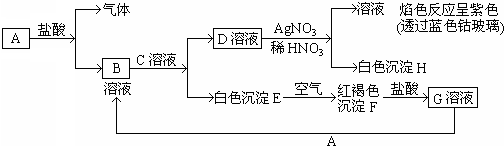
试回答:
(1)写出B的化学式______D的化学式______.
(2)写出由E转变成F的化学方程式______.
(3)写出用KSCN鉴别G溶液的离子方程式______;向G溶液加入A的有关离子反应方程式______.
5、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。请回答:
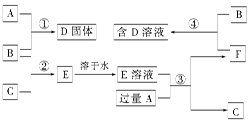
(1)A是?,B是?,C是?。(请填化学式)
(2)反应①的化学方程式为:?。
(3)反应③的化学方程式为:?。
(4)反应④的化学方程式为:?。