1、填空题 (10分)已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如下图所示,请按要求写出有关反应式,是离子反应的只写离子方程式。
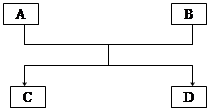
(1)若A、D的组成元素同主族:
①B是水
②B、C均为氧化物:
(2)若A、D的组成元素不同主族
①B是水且水是还原剂:
B是水且水是氧化剂
②B、C均为氧化物
参考答案:(10分)(1)①2Na+2H2O=2Na++2OH-+H2↑;? ②2C+SiO2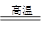 Si+2CO↑;
Si+2CO↑;
(2)①2F2+2H2O=4HF+O2;C+H2O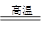 CO+H2; ②2Mg+CO2
CO+H2; ②2Mg+CO2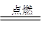 2MgO+C
2MgO+C
本题解析:根据转化特点可知,这是一个置换反应
(1)若A、D的组成元素同主族,则符合这种置换反应的是:①B是水,反应式为2Na+2H2O=2Na++2OH-+H2↑。②B、C均为氧化物,反应式为2C+SiO2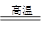 Si+2CO↑。
Si+2CO↑。
(2)若A、D的组成元素不同主族,①B是水且水是还原剂,则反应式为2F2+2H2O=4HF+O2;B是水且水是氧化剂,则反应式为C+H2O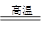 CO+H2;②B、C均为氧化物,则反应式为2Mg+CO2
CO+H2;②B、C均为氧化物,则反应式为2Mg+CO2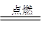 2MgO+C。
2MgO+C。
本题难度:简单
2、填空题 已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol? L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol ? L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
参考答案:(每空2分,最后一空每空3分,共计15分)
(1)2NH4Cl+Ca(OH)2 ?CaCl2+2H2O+2NH3↑?(2)2:3
?CaCl2+2H2O+2NH3↑?(2)2:3
(3)酸性;NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(4)取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+
(5)D>A=H?(6)110ml
本题解析:C为常见液体,则C可能是水。通常状况下甲、乙、丙、丁等为气体单质,则丙和丁应该是氢气和氧气。A和B都是化合物,且都是气体。又因为A和B可以反应生成D,D和F反应生成B、C、I,且该反应是重要的实验室制取气体的反应,由此可以推测,该反应是实验室制取氨气的反应,所以丁是氢气,丙是氧气,B能和氧气反应生成水和E,所以B是氨气,则乙是氮气,A是氯化氢,甲是氯气,D是氯化铵,F是氢氧化钙,I是氯化钙。E是NO,G是NO2,NO2溶于水生成硝酸和NO,则H是硝酸。
(1)反应④的化学方程式为2NH4Cl+Ca(OH)2 ?CaCl2+2H2O+2NH3↑。
?CaCl2+2H2O+2NH3↑。
(2)氨气与NO反应生成氨气和水,反应的化学方程式为4NH3+6NO=5N2+6H2O,其中还原剂是氨气,氧化剂是NO,氮气既是氧化产物,也是还原产物。由于还原剂与氧化剂的物质的量之比是2:3,所以该反应氧化产物与还原产物的物质的量之比也为2:3。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合恰好反应生成氯化铵,溶液中NH4+水解,所以溶液显酸性,反应的离子方程式为NH4++H2O NH3·H2O+H+。
NH3·H2O+H+。
(4)D是氯化铵,阳离子是NH4+,NH4+能和碱反应生成氨气,因此可以通过检验氨气来证明晶体中含有NH4+,所以正确的操作是取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+。
(5)盐酸和硝酸都是酸抑制水的电离,在二者浓度相同的条件下对水的抑制程度相同。氯化铵是强酸弱碱盐,溶于水NH4+水解,促进水的电离,所以pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是D>A=H。
(6)溶液中均没有出现红色,则溶液中的溶质分别是氯化亚铁和硝酸亚铁,且二者的物质的量均是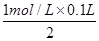 =0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是
=0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是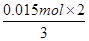 =0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。4+检验、盐类水解、外界条件对水电离平衡的影响以及氧化还原反应的有关计算等
=0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。4+检验、盐类水解、外界条件对水电离平衡的影响以及氧化还原反应的有关计算等
本题难度:一般
3、填空题 (1)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
①通甲烷的铂丝为原电池的______极,发生的电极反应为______.
②该电池工作时(放电)反应的总化学方程式为______.
(2)X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为______;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为______
③将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为______.
参考答案:(1)①燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;?
②甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O;
故答案为:CH4+2O2+2OH-=CO32-+3H2O;
(2)①Y是短周期非金属元素的单质且常温下为固体,和Z反应生成气体,所以Y只能是S;硫和非金属单质反应且生成的物质是气体,所以非金属单质为氢气、氧气,A在空气中充分燃烧可生成B,所以A硫和氢气反应的产物,B是硫和氧气反应的产物,从而确定X是氢气,Z是氧气,A是硫化氢,B是二氧化硫.
故答案为:SO2;
?②H2S是二元弱酸,能和氢氧化钠反应生成硫化钠和水,当硫化氢过量时硫化钠和硫化氢反应生成硫氢化钠.
故答案为:H2S+OH-=HS-+H2O;
③氯气有强氧化性,二氧化硫既有氧化性又有还原性,当遇到强氧化剂时,二氧化硫作还原剂被氧化,所以二氧化硫和氯气的水溶液反应生成盐酸和硫酸.
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
本题解析:
本题难度:一般
4、推断题 物质X、Y、Z有如下转化关系
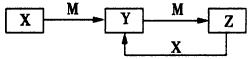
请回答下列问题:
(1)若X、Y、Z均为含铝元素的化合物,M的化学式可以是__________________。
(2)若M是第ⅣA族某元素的最高价氧化物,且M为气体,组成X的阴阳离子均含有10个电子。Y溶液中离子浓度大小顺序为:__________________。
(3)若X是一种黄绿色气体,M是一种常见金属。写出Z→Y的离子方程式:_____________________。
(4)若X、Y、Z中都含有硫元素,已知下列两个热化学方程式:
X转化为Y:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-Q1kJ/mol;
X转化为Z:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=- Q2 kJ/mol
请写出X与Z反应转化为Y的热化学方程式:_____________________。
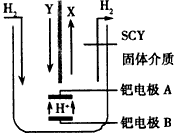
(5)若X、Y、Z中均含有N元素,则在常压下把氢气和用氦气稀释的Y气体,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜作电极,电解可合成X气体(装置如图)。
①则在电解法合成X的电解池中_______(填“能”或“不能”)用水作电解质溶液的溶剂。钯电极A是电解池的______极(填“阳”或“阴”);
②该极上的电极反应式是______________。
参考答案:(1)NaOH或HCl(或其他合理答案)
(2)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-(3Q1- Q2)/2 kJ/mol
(5)①不能;阴;②N2+6e-+6H+=2NH3
本题解析:
本题难度:一般
5、选择题 (14分)中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体,
C、D两种气体均能使澄清石灰水变浑浊,则A与B反应的方程式是?,已知具有刺激性气味的C气体和Cl2都能漂白某些有色物质,如果将两种气体等物质的量通入到品红溶液中的实验现象为?原因是?。
如果将两种气体非等量通入到水中,为了验证哪种气体过量,某兴趣小组的同学准备了以下试剂: ① 氯化铁溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液? ④ 苯酚溶液
⑤ 品红溶液? ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,再加入
?(选填一个序号)试剂,发生的现象是:?;
若C过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,发生的现象
是:?。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;C是漂白粉的有效成分,则C发生水解反应的离子方程式是?。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阳离子的方法是?
?(简述操作过程及结论)。
参考答案:(1)C + 2H2SO4(浓)  ?CO2↑+2SO2↑+2H2O?(2分)
?CO2↑+2SO2↑+2H2O?(2分)
无现象(1分);Cl2+SO2+2H2O=4H++2Cl―+SO42―,失去漂白性(2分)
②(1分)?③(或④)(1分)?溶液呈现红色(或紫色)(1分)
⑤(或⑥)(1分)?红色褪去(紫红色褪去)(1分)
(2)ClO-+ H2O  ?HClO + OH-?(2分)
?HClO + OH-?(2分)
(3)取少量A溶于水配成溶液于试管中,向该溶液中加入NaOH并加热,用湿润的红色石蕊试纸放于管口检验生成气体,石蕊试纸变蓝证明溶液中含有NH4+。?(或用浓盐酸检验,有白烟生成)?(2分)
本题解析:略
本题难度:简单