1、填空题 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表是元素周期表的一部分,根据周期表知识回答下列问题。
?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| A
| ?
| ?
|
?
| B
| C
| ?
| ?
| D
| E
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)C 和D元素名称分别是__________、__________。
(2)比较这五种元素的原子半径从大到小? (填元素符号);
(3)上述五种元素的最高价氧化物对应水化物酸性最强的是?(填化学式);
(4)写出A和C形成的化合物与氢氧化钠溶液反应的离子方程式:
?;
(5)用电子式表示B和E形成化合物的过程:
?。
参考答案:(1)镁、硫?(2)Mg 、Al、S、Cl、O(3)HClO4
(4)Al2O3+2OH-=2AlO2-+2H2O (5)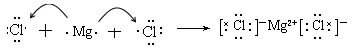
本题解析:根据元素在周期表中的相对位置可知,A是O,B是Mg, C是Al,D是S,E是Cl。
(1)C 和D元素名称分别是镁、硫。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以这五种元素的原子半径从大到小Mg 、Al、S、Cl、O。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,又因为同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,所以五种元素的最高价氧化物对应水化物酸性最强的是HClO4。
(4)A和C形成的化合物是氧化铝,属于两性氧化物,因此与氢氧化钠溶液反应的离子方程式是Al2O3+2OH-=2AlO2-+2H2O。
(5)B和E形成的化合物是氯化镁,属于含有离子键的离子化合物,所以其形成过程可表示为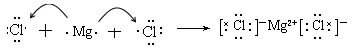 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
2、选择题 关于原子模型的演变过程,正确的是( )。
A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型
D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
参考答案:D
本题解析:原子模型的演变过程是:道尔顿原子模型、汤姆逊原子模型、卢瑟福原子模型、玻尔原子模型、量子力学模型。A、B、C均错误,所以选D。
本题难度:简单
3、选择题 同族元素所形成的同一类型的化合物,其 结构和性质往往相似。化合物PH4I是一种白色晶体
结构和性质往往相似。化合物PH4I是一种白色晶体 ,下列对它的描述中正确的是
,下列对它的描述中正确的是
A.它是一种共价化合物
B.在加热时此化合物不能分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和 HI化合而成
HI化合而成
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是
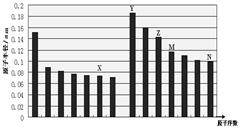
A.最高价含氧酸的酸性:M>N
B.离子半径:X<Y
C.X和Y形成的化合物中一定含有含离子键
D.化合物MX2能与碱反应,不能与任何酸反应
参考答案:C
本题解析:图中14种元素分别位于第二、三周期第IA~VIIA族,由于同周期主族元素的原子半径随原子序数的增大而减小,同主族元素的原子半径随原子序数的增大而增大,则图中X、Y、Z、M、N分别为氧、钠、铝、硅、氯元素。M、N分别是硅、氯,非金属性:Si<Cl,最高价氧化物酸性:H2SiO3<HClO4,故A项错误;X、Y分别为氧、钠,O2—、Na+都具有28电子层结构,离子半径与核电荷数成反比,则氧离子的半径比钠离子的半径大,故B项错误;X、Y分别为氧、钠,二者形成的化合物分别为氧化钠、过氧化钠,Na2O只有离子键、Na2O2既有离子键又有共价键,故C项正确;X、M分别为氧、硅,二者形成的二氧化硅是酸性氧化物,与碱能反应,氢氟酸是唯一能与二氧化硅反应的酸,故D项错误。
本题难度:一般
5、选择题 A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A>B;?②离子半径A>B;?③A的正价与B的负价绝对值一定相等;
④电负性A<B;?⑤电离能A>B。
其中正确的组合是(?)
A.①④? B.①②③? C.①④⑤? D.②③⑤
参考答案:A
本题解析:A元素的阳离子与B元素的阴离子具有相同的电子层结构,则A是金属,B是非金属,位于A的上一周期。原子半径是A>B,原子序数也是A>B,所以离子半径是B>A。金属性越强,电负性越小,电离能也越小,金属性是A>B,所以正确的答案是A。
本题难度:一般