1、填空题 (16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H="b" KJ/mol (Ⅱ)
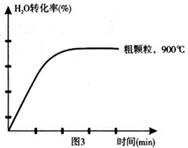
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。

(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
参考答案:(1)(2a+b)kJ/mol (2分)(无kJ/mol或“2a+bkJ/mol”扣1分,其他不给分)
(2)作催化剂(2分)
(3)①细颗粒FeO表面积大,与H2的接触面大,反应速率加快;
(3分)(“增大接触面、加快反应速率”、“接触面越大,反应速率越快”等合理表达给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分);
②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol,
H2O(g)+3FeO(s) Fe3O4(s)+ H2(g)
Fe3O4(s)+ H2(g)
开始(mol):0.2 0.6 0 0
转化(mol):0.08 0.24 0.08 0.08
平衡(mol):0.12 0.36 0.08 0.08
K= =0.6
=0.6
(4) (3分)
(3分)
本题解析:(1)已知H2O(g)+3FeO(s) Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4
Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4
本题难度:困难
2、简答题 一种混合动力车,可以分别用电动机、内燃机或者二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车和下坡时内燃机提供推动力,使电动机处于充电状态.目前内燃机以汽油为燃料,电动机一般使用镍氢电池(KOH作电解液).
试分析回答下列问题:
(1)已知汽车在刹车和下坡时,镍氢电池两电极反应分别为:甲电极:M+H2O+e-→MH+OH-(M为储氢合金,MH为吸附了氢原子的储氢合金)乙电极:Ni(OH)2+OH--e-→NiOOH+H2O则在这一过程中甲、乙两电极的名称分别是:甲:______;乙:______.
(2)当汽车上坡或加速时,镍氢电池两电极反应分别为:甲电极:______;乙电极:______;电极周围溶液的pH变化是(选填“增大”或“不变”或“减小“,下同)甲______;乙______.
(3)内燃机工作时因为部分汽油不完全燃烧会产生污染大气的CO,已知在常温常压下:
C8?H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-5121.9kJ/mol
2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
H2O(g)=H2?O(1);△H=-44.0kJ/mol
写出汽油不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
(4)为降低汽车尾气中的一氧化碳的浓度,可采取在汽车的排气管上增加一个补燃器,通过下列反应来实现转化:
2CO(g)+O2(g)?2CO2(g)
已知在温度为T的条件下,当补燃器中化学反应速率V(正)=V(逆)时,各物质浓度存在下列恒定关系:
=108
在温度为T的条件下,若某汽车排人补燃器的CO、CO2的浓度分别为1.0×10-5mol?L-1和1.01×10-4mol?L-1,要在该温度下使最终尾气中CO的浓度降为1.0×10-6mol?L-1,则补燃器中应不断补充O2,并使O2浓度保持在______mol?L-1.
参考答案:(1)在刹车和下坡时内燃机提供推动力,使电动机处于充电状态,甲电极发生还原反应,为阴极,乙电极失电子发生氧化反应,为阳极,故答案为:阴极;阳极;
(2)混合动力车上坡或加速时,电动机提供推动力,是电池放电,NiOOH得电子被还原转变为Ni(OH)2,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,乙电极周围因氢氧根离子的浓度增大,故pH将增大,甲电极MH的失电子被氧化,电极方程式为MH+OH--e-=M+H2O,消耗氢氧根离子,氢氧根离子浓度减小,则pH减小,
故答案为:MH+OH--e-=M+H2O;NiOOH+H2O+e-=Ni(OH)2+OH-;减小;增大;
(3)已知:①C8?H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-5121.9kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2?O(1);△H=-44.0kJ/mol
利用盖斯定律,将①-②×4+③×9可得:C8?H18(1)+172O2(g)=8CO(g)+9H2O(l),
△H=-5121.9kJ/mol-(=-566.0kJ/mol)×4+9×(-44.0kJ/mol)=-3253.9kJ/mol,
故答案为:C8?H18(1)+172O2(g)=8CO(g)+9H2O(l);△H=-3253.9kJ/mol;
(4)若某汽车排人补燃器的CO、CO2的浓度分别为1.0×10-5mol?L-1和1.01×10-4mol?L-1,要在该温度下使最终尾气中CO的浓度降为1.0×10-6mol?L-1,根据方程式2CO(g)+O2(g)?2CO2(g)可知CO2的浓度变为1.01×10-4mol?L-1+(1.0×10-5mol?L-1-1.0×10-6mol?L-1)=1.1×10-4mol?L-1,
则:c(CO2)2c(CO)2×c(O2)=108=(1.1×10-4)2(1.0×10-6)2×c(O2),
c(O2)=1.21×10-4,故答案为:1.21×10-4.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( ? )
A.甲烷的标准燃烧热为-890.3KJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3KJ?mol-1
B.500℃,30Mpa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3KJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6KJ?mol-1
2NH3(g)△H=-38.6KJ?mol-1
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列依据热化学方程式得出的结论正确的是
[? ]
A.已知C(石墨, s)=C(金刚石, s); ΔH>0 则金刚石比石墨稳定
B.已知C(s)+O2(g)= CO2(g) ΔH1,C(s)+1/2O2(g)= CO(g) ΔH2;则ΔH1>ΔH2
C.已知2H2(g)+ O2(g)= 2H2O(g);ΔH=-483.6kJ/mol 则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);ΔH=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
参考答案:D
本题解析:
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数的值,下列说法中正确的
①一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:3H2(g)+N2(g) 2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
③14.2g硫酸钠固体中含有0.1NA个硫酸钠分子;
④2gD216O中含有的质子数?中子数?电子数均为NA
⑤标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑥将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A.①③⑥
B.④⑤⑥
C.①②④
D.①⑥