1、填空题 (1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
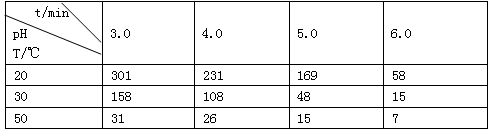
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0? b. 10°C、pH=4.0? c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)
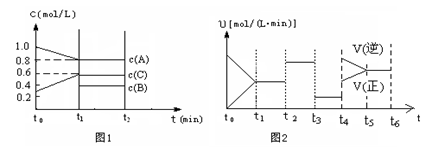
①你认为t3时改变的条件是?(填写“加压”或“减压”),B的起始物质的量为?mol;
②各阶段平衡时对应的平衡常数如下表所示:
时间段
| t1~t2
| t2~t3
| t3~t4
| t5~t6
|
平衡常数
| K1
| K2
| K3
| K4
|
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系? 写此条件下该反应的热化学方程式? ________________?
(3)工业上一般采用CO(g) + 2H2(g)?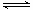 ?CH3OH(g)反应合成甲醇。
?CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为?,此时的温度?250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是?
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:?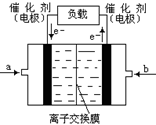
参考答案:(1)①(1分)OH-;②(2分)b a c
(2)①(1分)减压?(2分)1.0
②(1分)K1 =K2=K3 >K4
③(2分)2A(g)+B(g) 3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
(3)①(2分)80% ,(1分)<
②氧气(1分)? CH3OH - 6e- + 8OH - ="=" CO3 2-?+?6H2O (2分)
本题解析:(1)①pH增大,说明OH-的浓度增大,这表明对O3分解起催化作用的是OH-;②50°C、pH=3.0,O3的浓度减少一半所需的时间31min,即 40°C、pH="3.0" ,O3的浓度减少一半所需的时间大于31min,而30°C、pH=6.0,O3的浓度减少一半所需的时间为15min,所以30°C、pH=6.0,O3的浓度减少一半所需的时间小于15min,故O3的分解速率按依次增大的顺序为b a c;(2)①t3时,正逆反应都同时减少,所以t3时改变的条件是减压,根据图1可以知道,A的物质的量的浓度减小了0.2mol/L,C增加了0.3mol/L,故B为反应物,且B的物质的量减少0.1mol/L,所以B起始物质的量为(0.4+0.1)×2=1.0mol,②该反应的化学方程式为
2A+B 3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g)
3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g) 3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)?
3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)?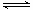 ?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,
?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,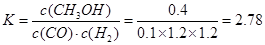 ,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
CH3OH -6e- +8OH -=CO3 2-?+?6H2O。
点评:本题考查了化学平衡、原电池,该题考查的知识面比较广,综合性强,有一定的难度。
本题难度:一般
2、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)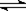 N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数(?)
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数(?)
A.不变
B.增大
C.减小
D.无法判断
参考答案:C
本题解析:由于反应物和生成物均是一种,所以在加入NO2时相当于是增大压强,平衡向正反应方向移动,NO2的体积分数降低,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和创新思维能力,提高学生的灵活应变能力和应试能力。
本题难度:简单
3、选择题 一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2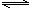 N2O4,在此温度下,再向容器通入一定量NO2,重新建立平衡后,容器中NO2的体积分数? (? )
N2O4,在此温度下,再向容器通入一定量NO2,重新建立平衡后,容器中NO2的体积分数? (? )
A.减少
B.增大
C.不变
D.无法判断变化情况
参考答案:A
本题解析:
正确答案:A
相当于对原平衡进行加压,平衡正向移动,重新建立平衡后,容器中NO2的体积分数减少。
本题难度:一般
4、选择题 在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+2B(气) xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为?
xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为?
A.x=3? y=1? B.x=4? y="1" ?C.x=5? y =1? D.x=8? y=2
参考答案:C
本题解析:由于是保持压强和温度不变,所以要满足平衡等效,则A和B的物质的最初物质的量之比应该满足3︰2。因此4LC和0.8LD就必须满足相应的化学计量数之比,即x︰y=4︰0.8=5︰1,所以正确的答案选C。
本题难度:一般
5、选择题 T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分
含量与时间的关系如图-2所示。下列分析正确的是?
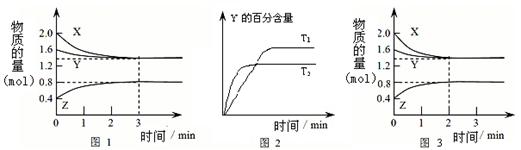
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
B.0~3 min内,v(X)=0.2 mol?L-1?min-1
C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆
D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强
参考答案:AC
本题解析:根据特异性1可知,X,Y的物质的量分别减少了2.0mol-1.4mol=0.6mol、1.6mol-1.4mol=0.2mol。Z的物质的量增加了0.8mol-0.4mol=0.4mol。所以根据变化量之比是相应的化学计量数之比可知,方程式为3X(g)+Y (g)  2Z(g)。A正确;反应进行的前3 min内,用X表示的反应速率 v(X)=
2Z(g)。A正确;反应进行的前3 min内,用X表示的反应速率 v(X)= =0.1 mol/(L? min),B错误;根据图像2可知,T1小于T2,温度高,Y的含量低,说明升高温度平衡向正反应方向移动,所以正反应是吸热反应,即△H大于0,重新平衡前v正>v逆 ,C正确;根据图像3可知,平衡状态没有改变,说明改变的条件是加入了催化剂。因为正反应是体积减小的、吸热的可逆反应,所以升高温度或增大压强,平衡都向正反应方向移动,转化率增大,都会改变平衡状态,D错误;
=0.1 mol/(L? min),B错误;根据图像2可知,T1小于T2,温度高,Y的含量低,说明升高温度平衡向正反应方向移动,所以正反应是吸热反应,即△H大于0,重新平衡前v正>v逆 ,C正确;根据图像3可知,平衡状态没有改变,说明改变的条件是加入了催化剂。因为正反应是体积减小的、吸热的可逆反应,所以升高温度或增大压强,平衡都向正反应方向移动,转化率增大,都会改变平衡状态,D错误;
本题难度:一般