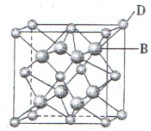
1、填空题 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为?
参考答案:(15分)
(1)1s22s22p63s23p63d10或[Ar]3d10(2分)?(2)? V形? sp2 (各2分)
(3)NH3分子与H2O 分子间形成氢键(2分)?
(4)CaF2(2分)?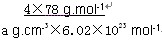 ?(3分)?(5)12(2分)
?(3分)?(5)12(2分)
本题解析:
有A、B、C、D、E、F六种元素,A为氢元素; B为氟元素; C为氮元素; F为硫元素; E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×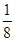 +6×
+6×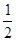 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
(1)E是Cu元素,是29号元素,原子基态时的电子排布式为[Ar]3d104s1;
(2)A2F分子是H2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp3杂化;
(3)NH3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水,
(4)由晶胞结构图可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为:
8×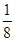 +6×
+6×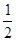 =4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,晶胞的质量为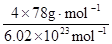 ,晶体的密度为ρ(g?cm-3),则晶胞的体积是
,晶体的密度为ρ(g?cm-3),则晶胞的体积是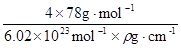 ;
;
(5)Cu单质为面心立方最密堆积,以面心上的Cu为中心可以做三个切面,每个切面上有四个Cu原子,则Cu原子的配位数为12个。
考点定位:本题考查了位置结构性质的相互关系应用;原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断;化学键和等知识,题目综合性较大,难度较大,。
本题难度:一般
2、选择题 某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为
[? ]
A.HX
B.H2X
C.XH3
D.XH4
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列有关化学用语表示正确的是( )
A.乙炔的电子式:H:C:;C:H
B.对甲基苯酚的结构简式:

C.3,3-二甲基-1-戊烯的键线式:

D.乙醇分子的比例模型:

参考答案:C
本题解析:
本题难度:简单
4、选择题 下列物质含有离子键的是( )
A.Cl2
B.NaOH
C.CO2
D.H2O
参考答案:B
本题解析:
本题难度:简单
5、选择题 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。下列判断正确的是
A.AlCl3为离子化合物
B.SiCl4为共价化合物
C.P 与Cl可形成离子键
D.K与Mg 形成共价键
参考答案:B
本题解析:根据元素的电负性可知,铝元素和氯元素的电负性差小于1.7,所以氯化铝是共价化合物;同样氯元素和硅元素的电负性差小于1.7,形成的四氯化硅是共价化合物;氯元素与P元素的电负性也是形成小于1.7的,形成的化合物是共价化合物;K和Mg都是活泼的金属,二者不能形成共价键,选项B正确,其余都是不正确的,所以正确的答案选B。
本题难度:一般