1、选择题 1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60),开辟了化学研究的新领域。富勒烯(C60)由于具有空心的类似足球形状的结构,也称为足球烯。对于下列有关C60的说法中正确的是
A.C60在一定条件下可以与CuO发生置换反应
B.C60的摩尔质量是720
C.金刚石、石墨和足球烯(C60)三者和足量氧气反应的最终产物不同
D.金刚石、石墨和足球烯(C60)的性质完全相同
2、选择题 下列说法正确的是
[? ]
A.由极性键构成的分子都是极性分子
B.含非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子,一定是极性分子
3、选择题 下列关于化学键的叙述中,正确的是
[? ]
A.化学键存在于原子之间,也存在于分子之间
B.两个原子之间的相互作用叫化学键
C.离子键是阴、阳离子之间的相互吸引力
D.化学键通常指的是相邻两个或多个原子间的强烈的相互作用
4、选择题 葡萄糖的分子式是( )
A.C6H12O6
B.C5H10O5
C.C4H8O2
D.C3H6O2
5、填空题 卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ?区;氟原子的电子排布图为?溴原子的价电子排布式为?.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是?
(3)已知高碘酸有两种形式,化学式分别为H5IO6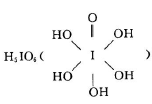 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为?。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为?。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ?式发生。
A.CsICl2=CsCl+ICl? B.CsICl2 ="CsI" +Cl2
(5)ClO2-的空间构型为?型,中心氯原子的杂化轨道类型为?,写出一个ClO2-的等电子体 ?。
(6)如图为碘晶体晶胞结构。有关说法中正确的是?。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3.NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?。