1、选择题 已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为
A.A-x
B.A-x-n
C.A-x+n
D.A+x-n
参考答案:B
本题解析:阳离子Rn+,质量数为A,核外有X个电子,所以其质子数Z=X+n,由于中子数=质量数-质子数,故质子数=A-(X+n)=A-x-n。
故选B。
点评:本题考查质子数、核外电子数、离子电荷的关系以及质量数、质子数、中子数的关系,难度较小,掌握好相互之间的关系即可顺利解答.要理解、熟记相互间的关系。
本题难度:简单
2、选择题 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化的如下图所示,下列说法正确的是

A.原溶液一定含有Na2SO4
B.反应最后形成的溶液中的溶质为NaCl
C.原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32-
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
参考答案:C
本题解析:根据图像可知,最初没有沉淀生成,这说明溶液中一定含有OH-,则溶液中就一定没有Fe3+、Mg2+、Al3+等离子,因此根据溶液的电中性可知,一定含有钠离子。根据图像可知,当沉淀不再发生变化时,继续加入盐酸,盐酸仍然被消耗,所以一定含有CO32-。如果继续再加入盐酸,沉淀开始减少,但不完全消失,这说明沉淀一定是氢氧化铝和硅酸沉淀,所以溶液中一定含有AlO2-、SiO32-。和碳酸钠反应的盐酸是2体积,而与氢氧化铝反应的盐酸是4体积,所以原溶液中含有CO32-与AlO2-的物质的量之比为1:4。由于不能确定是否含有SO42-,所以选项A是和B是不正确的,因此正确的答案选C。
本题难度:一般
3、填空题 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系:
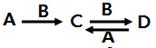
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
参考答案:(1) (1分)?
(1分)?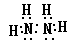 ?(1分)
?(1分)
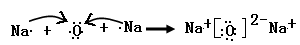 ? (2分)
? (2分)
(2)Al>N>O? (2分)? > (1分)
(3)H2O2? (1分)?H2O2+CN-+OH-=CO32-+NH3 ↑? (2分)
(4) AlO2- +2H2O Al(OH)3 +OH- (2分)? Al3 ++3AlO2- +6H2O?="4" Al(OH)3↓(2分)
Al(OH)3 +OH- (2分)? Al3 ++3AlO2- +6H2O?="4" Al(OH)3↓(2分)
本题解析:短周期元素为从氢到氩,地壳中含量最高的金属元素为Al,故M为Al ;Z 的最外层电子数是电子层数的3倍,得知Z的电子层数为2,最外层电子数为6,故Z为O;X 的原子半径比Y 的小,说明X为H,X 与W 同主族,W的原子序数介于Z和M之间,得知W为Na, 原子最外层电子数之和为23,得知Y和N的最外层电子数之和为12,Y的最外层电子数只能小于6,故N为Cl,Y为N。
(1)X、Y分别为N、H,能形成的18电子化合物只可能是N2H4
(2)根据元素周期律,同周期元素半径逐渐减小,同主族元素半径逐渐增大,判断Al>N>O;O的非金属性大于Cl的非金属性,其氢化物稳定性大于Cl的氢化物稳定性。
(3)H和O既能形成共价键又能形成离子键的化合物只能是H2O2
(4)此题考查AlO2-、 Al(OH)3、 Al3 +三者相互转化的关系
本题难度:一般
4、选择题 应用元素周期,判断下列语句,其中正确的组合是()
①第一主族元素的氧化物都是离子化合物
②氢化物的稳定性:
③砷(As)的最高价氧化物对应水化物的酸性比磷酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥成(At)单质有颜色,且颜色较深
A.①③⑤
B.③⑥
C.②③④
D.④⑥
参考答案:B
本题解析:正确答案B
①第一主族元素的氧化物都是离子化合物,不正确,H2O
②氢化物的稳定性: ,不正确,从上到下,氢化物稳定性变弱,HCl>HI
,不正确,从上到下,氢化物稳定性变弱,HCl>HI
③砷(As)的最高价氧化物对应水化物的酸性比磷酸弱,正确
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性,不正确,NH3溶于水后呈碱性。
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应,不正确,铊(Tl)只与酸反应。
⑥成(At)单质有颜色,且颜色较深,正确
本题难度:简单
5、选择题 X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大。下列说法正确的是
A.ZO3和水反应形成的化合物是离子化合物
B.粘在试管内壁上的Z可以用YZ2洗涤
C.最高价氧化物对应水化物的碱性:X>W
D.X位于金属与非金属的分界线处,常用来做半导体材料
参考答案:B
本题解析:根据题意知,X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素,则X为铝元素;Y原子最外层电子数是电子总数的2/3,则Y为碳元素;Z的最高正化合价与最低负化合价的代数和为4,则Z为硫元素;W原子在短周期中原子半径最大,W为钠元素。A、SO3和水反应形成的化合物硫酸是共价化合物,错误;B、硫易溶于二硫化碳,粘在试管内壁上的S可以用CS2洗涤,正确;C、最高价氧化物对应水化物的碱性:Na>Al,错误;D、Al为活泼金属,是电的良导体,错误。
本题难度:一般