1、选择题 A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A
B.B与E可以形成EB2型化合物
C.A与E形成的化合物中含有离子键
D.最高价氧化物对应的水化物碱性:C<D
参考答案:B
本题解析:考查原子核外电子的排布及元素周期律的应用。B原子最外层电子数是内层电子数的3倍,所以B是氧,则E是硫,因此C、D的核外电子数之和是24。又因为C的原子半径最大,原子序数小于硫的,且原子序数不超过18,所以C是Na,D是Al。A和C同主族,所以A是氢或Li,和硫形成的化合物不一定含有离子键。钠的金属性强于铝的,因此氢氧化钠的碱性强于氢氧化铝的,所以正确的答案是C。
本题难度:一般
2、选择题 下列物质既能跟盐酸反应,又能跟NaOH溶液反应,还能跟H2O反应的是
A.NH4Cl
B.KAlO2
C.KHCO3
D.NaHSO4
参考答案:C
本题解析:
本题难度:困难
3、选择题 有一无色透明溶液,可能含有K+,Al3+,Mg2+,Fe2+,NH4+,Cl-,SO42-,HCO3-↑中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色.②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解.③加入5mL?0.1mol/LBaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2g沉淀.由此推知,原溶液中
A.一定有Al3+,Mg2+,Cl-,SO42-,
B.一定没有 Mg2+,Fe2+,HCO3-
C.不能确定是否含有Cl-
D.可能有K+,NH4+,Cl-,
参考答案:A
本题解析:分析:酸能使甲基橙溶液显红色,铝离子和NaOH溶液反应先产生白色沉淀,然后白色沉淀能完全溶解,氢氧化镁沉淀不溶于氢氧化钠溶液中,硫酸钡为白色沉淀,银离子和氯离子反应生成白色沉淀氯化银.
解答:滴加甲基橙溶液显红色,说明溶液显酸性,所以一定不存在HCO3-,逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解,说明一定同时存在镁离子和铝离子,加入5mL?0.1mol/LBaCl2溶液至不再产生白色沉淀,说明一定存在SO42-,取上层清液加入足量AgNO3溶液,得到沉淀,AgCl的物质的量为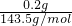 =0.0014mol,5mL0.1mol/LBaCl2溶液中氯离子的物质的量为0.001mol,则原溶液中一定存在氯离子,故选A.
=0.0014mol,5mL0.1mol/LBaCl2溶液中氯离子的物质的量为0.001mol,则原溶液中一定存在氯离子,故选A.
点评:本题考查学生常见离子的检验方法,可以根据所学的知识来回答,难度不大.
本题难度:一般
4、选择题 下列叙述正确的是?
A.Na、Mg、Al元素最高化合价依次升高
B.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
C.N、O、F元素非金属性依次减弱
D.Li、Na、K原子的电子层数依次增多
参考答案:ABD
本题解析:试题分析:同周期自左向右,元素的最高价逐渐增大,A正确;同周期自左向右,元素的非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,B正确,C不正确;同主族自上而下,电子层数逐渐增多,D正确,答案选ABD。
考点:考查元素周期律的应用
点评:该题是基础性试题的考查,试题基础性强,侧重考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力,提高学生的学科素养。
本题难度:一般
5、选择题 下列有关反应离子方程式错误的是
A.KOH溶液与过量的SO2反应:OH-+SO2═HSO3-
B.Na2SO3溶液与稀硫酸反应SO32-+2H+═SO2↑+H2O
C.NaHSO3溶液中通入氯气:HSO3-+Cl2+H2O═SO42-+3H++2Cl-
D.石灰石与稀硝酸反应:CO32-+2H+═H2O+CO2↑
参考答案:D
本题解析:分析:A、KOH溶液与过量的SO2反应生成亚硫酸氢钾;
B、Na2SO3溶液与稀硫酸反应生成硫酸钠、水和二氧化硫;
C、NaHSO3溶液中通入氯气发生氧化还原反应生成硫酸氢钠和盐酸;
D、石灰石不溶于水,在离子方程式中应保留化学式.
解答:A、KOH溶液与过量的SO2反应生成亚硫酸氢钾,离子反应为OH-+SO2═HSO3-,故A正确;
B、Na2SO3溶液与稀硫酸反应生成硫酸钠、水和二氧化硫,离子反应为SO32-+2H+═SO2↑+H2O,故B正确;
C、NaHSO3溶液中通入氯气发生氧化还原反应生成硫酸氢钠和盐酸,离子反应为HSO3-+Cl2+H2O═SO42-+3H++2Cl-,故C正确;
D、石灰石与稀硝酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选D.
点评:本题考查离子反应方程式书写的正误判断,明确发生的化学反应是解答本题的关键,C选项是解答中的易错点,难度不大.
本题难度:一般