1、选择题 甲和乙都属于非金属元素,下列叙述中,不能说明甲原子得电子能力比乙强的是( )
A.甲比乙容易与氢气化合
B.甲单质能与乙的阴离子在水溶液中发生氧化还原反应
C.最高价氧化物对应的水化物的酸性甲强于乙
D.与某金属反应时,甲原子得电子数目比乙原子多
参考答案:A.甲比乙容易与氢气化合,则甲得电子的能力强,故A正确;
B.甲单质能与乙的阴离子在水溶液中发生氧化还原反应,甲置换出乙,则甲得电子的能力强,故B正确;
C.最高价氧化物对应的水化物的酸性甲强于乙,非金属性甲大于乙,则甲得电子的能力强,故C正确;
D.得电子的数目多少不能确定得电子的能力,则无法比较甲得电子能力比乙的强,故D错误;
故选D.
本题解析:
本题难度:简单
2、推断题 短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表

①D原子结构示意图为____________;A在周期表中的位置为________________;
②用电子式表示B和C形成的化合物 ___________;
③B和D简单离子的半径大小为__________;(用离子符号和“>”、“=”或“<”表示)
④元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水合物的酸性
⑤E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为
120.5。则该物质的结构式为___________________。
参考答案:①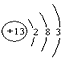 ;第一周期IA族或第二周期、第IVA族
;第一周期IA族或第二周期、第IVA族
②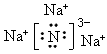 ;③r(N3-)>r(Al3+);
;③r(N3-)>r(Al3+);
④a;
⑤
本题解析:
本题难度:一般
3、选择题 下列元素中,属于第二周期的是( )
A.氢
B.碳
C.钠
D.氯
参考答案:A、H元素原子核外电子数为1,有1个电子层,处于第一周期,故A不符合;
B、C元素原子核外电子数为6,有2个电子层,处于第二周期,故B符合;
C、Na元素原子核外电子数为11,有3个电子层,处于第三周期,故C不符合;
D、Cl元素原子核外电子数为17,有3个电子层,处于第三周期,故D不符合;
故选B.
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答下列问题:
(1)E元素在周期表中的位置是_____________;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/mol,请写出A单质完全燃烧生成液态水时的热化学方程式:___________________;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是_____________;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于________化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为__________________;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:__________________________。
参考答案:(1)第二周期第Ⅰ主族
(2)H2(g)+1/2O2(g)==H2O(l) △H=-285.8KJ/mol
(3)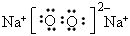
(4)①离子;②H++HSO3-==H2O+SO2↑
(5)S2- + H2O2 + 2H+ == S↓ +2H2O
本题解析:
本题难度:一般
5、推断题 已知X、Y、Z、W四种短周期元素的原子半径依次减小。在周期表中X与Y、Y与Z均位于同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数之比形成电子总数为 10的常见化合物。请判断X、Y、Z、W四种元素并回答下列问题(要求用确定后的元素符号及有关化学用 语表示):
(1)(XY)2分子中所有原子最外层都满足8电子结构,请写出其结构式:_________________;(XY)2可与W2化合生成WXY,其水溶液是一种酸,某浓度该酸的钾盐(KXY)溶液能使酚酞试液显红色,请用离子方程式表示其原因:____________________。
(2)已知乙炔在一定条件下可以三聚生成苯:3CH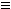 CH
CH 。三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:_________________。
。三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:_________________。
(3)三聚氰胺遇强酸或强碱性水溶液发生水解,氨基逐步被羟基取代生成三聚氰酸。三聚氰胺由于含氮量 高而被一些奶粉厂家非法掺入奶粉中以提高其产品的含氮量(俗称蛋白精),经研究表明三聚氰胺和三 聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭,严重则危及生命。试写出 三聚氰胺与稀盐酸反应直接生成三聚氰酸的离子方程式:_______________________。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将XZ2转化成有机物实现碳循环。如:
2XZ2(g)+2W2Z(l) =X2W4(g)+ 3Z2(g) △H=+1411.0 kJ/mol
2XZ2(g)+3W2Z(l) =X2W5ZW(1)+3Z2(g) △H=+1366.8 kJ/mol
则由X2W4水化制X2W5ZW反应的热化学方程式为_____________________。
(5)利用X2W5ZW燃料电池设计如图所示的装置:
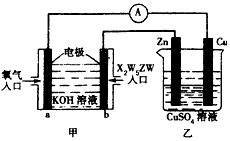
①该装置中Cu极为______极;
②写出b极的电极反应式:_____________;
③当铜片的质量变化12.8 g时,a极上消耗的O2在标准状况下的体积为_________L;甲、乙两装置中电 解质溶液pH的变化为甲______,乙_______(填“变大”、“变小”或“不变”)。
参考答案:(1)N C-C
C-C N;CN-+H2O
N;CN-+H2O HCN+OH- (2)
HCN+OH- (2)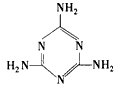
(3) (4)C2H4(g)+H2O(l)=C2H5OH(l) △H=-44. 2 kJ/mol
(4)C2H4(g)+H2O(l)=C2H5OH(l) △H=-44. 2 kJ/mol
(5)①阳;②C2H5OH+16OH--12e-=2CO32-+11H2O;③2.24;变小;不变
本题解析:
本题难度:困难