1、选择题 下列实验目的可以达到的是
A.电解熔融氯化镁制取金属镁
B.醋酸钠结晶水合物与碱石灰共热制取甲烷。
C.浓硫酸与溴化钠共热制取溴化氢
D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
参考答案:A
本题解析:略
本题难度:一般
2、简答题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
请回答下列问题:
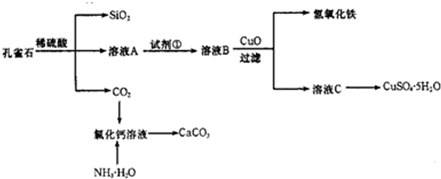
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为______(填代号).
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、______、过滤等操作.过滤时为了防止滤液飞溅,应______.
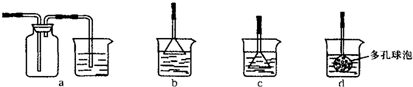
(3)制备CaCO3时,若实验过程中有氨气逸出,应选用下列______装置吸收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液进行氧化还原滴定,配制时等液面接近容量瓶刻度线时,应该继续进行的操作是______.滴定时需要用用KMnO4标准溶液润洗滴定管,润洗后的废液应从酸式滴定管的______排出.
参考答案:(1)由溶液B加入CuO可生成氢氧化铁沉淀可知,B应为含Fe3+的溶液,则试剂①应将Fe2+氧化为Fe3+,为不引入新的杂质,可用H2O2为氧化剂,可用KSCN检验Fe3+,
故答案为:c;d;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,过滤时为了防止滤液飞溅,应使漏斗下端玻璃管与烧杯壁紧靠,
故答案为:冷却结晶;使漏斗下端玻璃管与烧杯壁紧靠;
(3)氨气极易溶于水,且氨气有刺激性气味,防止污染大气,要有尾气处理装置,选用倒置的漏斗且紧贴水面,目的是防止倒吸,
故答案为:b;
(4)配制溶液时要进行定容,可用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平,润洗滴定管时,为充分润洗,应将润洗液从下口排出,
故答案为:用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平;下口.
本题解析:
本题难度:一般
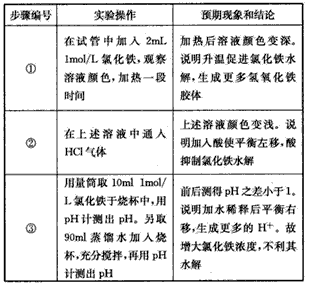
3、实验题 请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;
1mol/L盐酸、氯化氢气体、1mol/L氢氧化钠、1mol/L氯化铁、蒸馏水。 完成下列探究过程:
(1)写出FeCl3水解的离子方程式:_______________。
(2)针对FeCl3水解的影响因素提出假设:
假设1:溶液的酸碱性; 假设2:____; 假设3:____。
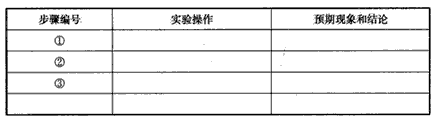
(3)基于以上3个假设,设计实验方案,将实验操作、预期实验现象和结论填在下表中。
参考答案:(l)Fe3++3H2O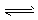 Fe(OH)3+3H+
Fe(OH)3+3H+
(2)氯化铁溶液的浓度;溶液的温度
(3) 
本题解析:
本题难度:一般
4、选择题 为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是( )
A.K2SO3是否被氧化(BaCl2)
B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液)
D.氢氧化钠是否被变质(BaCl2)
参考答案:A.K2SO3和K2SO4都能与BaCl2反应生成沉淀,不能用加入BaCl2的方法检验是否变质,应加入盐酸后在加入BaCl2,故A错误;
B.FeSO4被氧化生成Fe3+,Fe3+与KSCN反应,溶液为血红色,故B正确;
C.KI被氧化生成碘单质,加入淀粉变蓝色,故C正确;
D.氢氧化钠变质易生成Na2CO3,可加入BaCl2检验,故D正确.
故选A.
本题解析:
本题难度:简单
5、选择题 下列实验方案不能达到实验目的的是
?
| ?实验目的
| ?实验方案
|
A
| 研究催化剂对过氧化氢分解速率的影响
| 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一只试管中加入少量MnO2
|
B
| 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
| 向2mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液
|
C
| 可以鉴别这两种溶液
| 将Na2CO3溶液与HCl溶液相互滴加
|
D
| 测定铝箔中氧化铝的含量
| 取a g铝箔与足量稀盐酸充分反应,将逸出的气体通过碱石灰后,测其体积为bL(标准状况下)
|
?
参考答案:B
本题解析: A、二氧化锰可催化过氧化氢分解,正确;B、氢氧化钠溶液与氯化镁溶液反应时,氢氧化钠过量,再加氯化铁溶液生成氢氧化铁沉淀,错误;C、向碳酸钠溶液中滴加盐酸,先无气体后产生气体;向盐酸中滴加碳酸钠溶液立即产生气体,正确;D、bL气体为氢气,由氢气的体积计算出铝的物质的量,继而求出氧化铝的含量,正确。
本题难度:简单