1、选择题 下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
参考答案:D
本题解析:平衡常数与温度有关系,A正确;催化剂只能改变反应速率,但不能改变平衡状态,所以不能改变平衡常数,B正确;平衡常数发生变化,化学平衡必定发生移动,达到新的平衡,但化学平衡发生移动,平衡常数不一定生变化,C正确,D不正确,答案选D。
点评:该题是高考中的常见题型和重要的考点,主要是考查学生对平衡常数黑烟、影响因素以及与化学平衡移动的关系裂解掌握情况,有利于提高学生的应试能力,提升学生的学科素养。
本题难度:一般
2、填空题 Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应: N2(g)+3H2(g)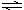 2NH3(g);△H<0
2NH3(g);△H<0
(1)工业生产中,该反应通常在高压下进行反应,做出此选择的理由是:
①?;
② ? 。
(2)开始时放入1mol N2和3mol H2,到达平衡后,生成amol NH3,若开始时放入χmol N2、3mol H2和y mol NH3,到达平衡后,NH3的物质的量为 3amol,则x= ? mol,y= ? mol。
Ⅱ、若该容器恒压、绝热(与外界不发生热交换),在一个与(2)反应前起始条件完全相同的容器中发生上述反应
(3)若开始时放入1mol N2和3mol H2,到达平衡后,生成b mol NH3,将b与(2)小题中的a进行比较?(选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
Ⅲ、某研究性学习小组为探究利用电化学原理合成氨,设计如图所示的装置,
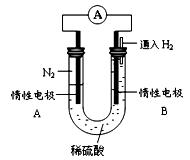
(4)电极B为?极
(5)电极A发生的电极反应式为?
(6)该电池工作一段时间后,电解质溶液pH?(填增大、减小或不变)
参考答案:
本题解析:略
本题难度:一般
3、选择题 下列能确认化学平衡发生了移动的是( )
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
参考答案:C
本题解析:若正逆反应同等程度加快或同等程度减慢,化学平衡都不移动;若反应物、生成物气体分子数相等,压强改变平衡不移动;使用催化剂时,正逆反应速率同等程度变化,平衡不移动,故正确答案为C。
本题难度:一般
4、选择题 已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(?)
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(?)
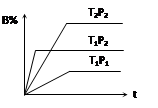
A.T1<T2、P1>P2、m+n>p,⊿H <0;
B.T1>T2、P1<P2、m+n>p,⊿H >0;
C.T1>T2、P1<P2、m+n<p,⊿H >0;
D.T1<T2、P1>P2、m+n<p,⊿H <0;
参考答案:C
本题解析:先看清横纵轴的意义:横轴表示时间,纵轴表示B的百分含量;
然后看线的走向:“T1P2、T2P2”线比较:在相同压强下,达平衡用时少的,温度高,即:T1 >T2;
“T1P1、T1P2”线比较:在相同温度下,达平衡用时少的,压强高,即:P2 >P1;
然后再看平行线部分:T1到T2(降温),B的百分含量增大,即平衡左移,说明逆向是放热的,则⊿H >0;
P1到P2(增压),B的百分含量增大,即平衡左移,说明逆向是气体体积减小的方向,则m+n<p;
本题难度:一般
5、选择题 可逆反应X+Y Z达到平衡时,下列各种说法错误的是( )
Z达到平衡时,下列各种说法错误的是( )
A.升高温度,的比值减小,表明正反应是吸热反应
B.增大压强,平衡不移动,说明Y,Z都是气体
C.若Y是气体,增大X的浓度,可使Y的转化率升高
D.若增大压强,混合气体的平均分子质量一定增加
参考答案:BD
本题解析:A选项中,升高温度,的比值减小,说明平衡向正反应方向移动,升高温度向吸热方向移动,说明正反应是吸热反应,故A选项正确。B选项中,增大压强平衡不移动,说明反应前后气体的计量数相等,或都不是气体。C选项中,增大一种反应物的浓度能提高另一种反应物的转化率,正确。D选项中,增大压强有可能平衡不移动。
本题难度:一般