1、简答题 向100mL?FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的
顺序为______>______>______.
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为______,从开始通入Cl2到n(Cl2)=0.12mol时的总反应的化学方程式为______.
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为______.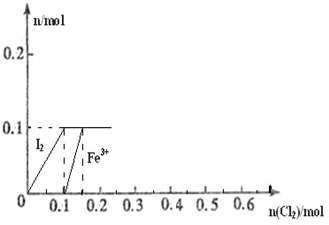
2、选择题 反应3NO2+H2O=2HNO3+NO中,被氧化的物质与被还原的物质的物质的量之比为( )
A.1:1
B.1:2
C.2:1
D.3:1
3、选择题 工业上利用反应:3Cl2+2NH3=N2+6HCl?检查氯气管道是否漏气。下列说法错误的是
A.该反应属于复分解反应
B.该反应中Cl2是氧化剂
C.若管道漏气遇氨就会产生白烟
D.该反应生成1molN2,有6mol电子发生转移
4、简答题 含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染.
其反应的离子方程式是:6NO3-+2zAl+2一H2O→3N2↑+2zAl(OH)3+6OH-
(2)现在要除去2x3含氮元素z.3xol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝______g;
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同;
①写出镁和含氮废水反应的离子方程式______;
②已知金属镁是从海水中提取的xgCl2,通过电解制得的.若要除去2x3含氮元素z.3xol的废水中的NO3-,则至少需要含z.n%(质量分数)xgCl2的海水______kg.
5、计算题 将0.3mol NaCl固体与0.1mol CuSO4·5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)?