1、简答题 向100mL?FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的
顺序为______>______>______.
(2)当n(Cl2)=0.12mol时,溶液中的离子主要为______,从开始通入Cl2到n(Cl2)=0.12mol时的总反应的化学方程式为______.
(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为______.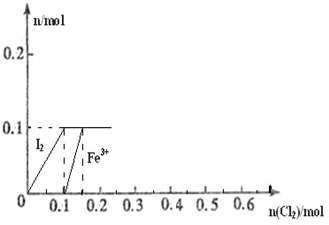
参考答案:(1)向100mL?FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,在氧化还原反应中还原性越强的微粒越溶液失电子,由此说明I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为I-、Fe2+、I2,故答案为:I-;Fe2+;I2;
(2)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol;向100mL?FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,所以当通入Cl2到n(Cl2)=0.12mol时,氯气和亚铁离子反应生成铁离子,2Fe2++Cl2=2Fe3++2Cl-,通入氯气的物质的量是0.02mol时,有0.04mol亚铁离子被氧化,还剩0.06mol亚铁离子,所以溶液中存在的离子是Fe2+、Fe3+、Cl-,发生的离子反应方程式为5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2,
故答案为:Fe2+、Fe3+、Cl-;5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2;
(3)但碘离子转化为碘酸根离子时,亚铁离子完全转化为铁离子,设碘酸根的物质的量是x,则氯离子的物质的量是8x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=8x×1,x=0.1,所以溶液中碘酸根的物质的量是0.1mol,氯离子的物质的量是0.8mol,根据Cl2~2Cl-知,氯气的物质的量是0.4mol,氯气的体积=0.4mol×22.4L/mol=8.96L,
故答案为:8.96L.
本题解析:
本题难度:一般
2、选择题 反应3NO2+H2O=2HNO3+NO中,被氧化的物质与被还原的物质的物质的量之比为( )
A.1:1
B.1:2
C.2:1
D.3:1
参考答案:C
本题解析:
本题难度:简单
3、选择题 工业上利用反应:3Cl2+2NH3=N2+6HCl?检查氯气管道是否漏气。下列说法错误的是
A.该反应属于复分解反应
B.该反应中Cl2是氧化剂
C.若管道漏气遇氨就会产生白烟
D.该反应生成1molN2,有6mol电子发生转移
参考答案:A
本题解析:
答案:A
A、不正确,属于置换反应或氧化还原反应;B、正确,Cl化合价降低;C正确,HCl+NH3=NH4Cl产物是白色固体;D、正确,N由-3价变为0价,生成1molN2,有6mol电子发生转移。
本题难度:简单
4、简答题 含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染.
其反应的离子方程式是:6NO3-+2zAl+2一H2O→3N2↑+2zAl(OH)3+6OH-
(2)现在要除去2x3含氮元素z.3xol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝______g;
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同;
①写出镁和含氮废水反应的离子方程式______;
②已知金属镁是从海水中提取的xgCl2,通过电解制得的.若要除去2x3含氮元素z.3xol的废水中的NO3-,则至少需要含z.n%(质量分数)xgCl2的海水______kg.
参考答案:(v)因为含氮八.3mo右e废水中eNO3-e物质e量为八.3mo右,根据化学方程式6NO3-+v八A右+v8H2O═3N2↑+v八A右(OH)3+6OH-,八.3mo右e硝酸根离子消耗金属铝e物质e量为八.3mo右×v八6=八.5mo右,所以需要金属铝e质量是:八.5mo右×27g/mo右=v3.5g,
故答案为:v3.5;
(2)①金属镁比铝能更快消除氮e污染,反应原理和金属铝相同,所以产物为氮气、氢氧化镁、氢氧根离子,
反应离子方程式为2NO3-+5Mg+6H2O═N2↑+5Mg(OH)2+2OH-,
故答案为:2NO3-+5Mg+6H2O═N2↑+5Mg(OH)2+2OH-;
②令至少需要含八.5%(质量分数)MgC右2e海水mkg,则:
5MgC右2~~~~5Mg~~~~2NO3-
5×图5g&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp; 2mo右
m×v八3g×八.5%&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp;&n手sp; 八.3mo右
所以5×图5gm×v八3g×八.5%=2mo右&n手sp;八.3mo右,解得m=v4.25,
故答案为:v4.25.
本题解析:
本题难度:一般
5、计算题 将0.3mol NaCl固体与0.1mol CuSO4·5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)?
参考答案:H2为0.224L;pH=13
本题解析:
本题难度:一般