1、填空题 铁、铝的混合物进行如下实验:
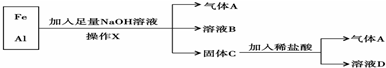
(1)操作X的名称是______.
(2)气体A是______(填化学式).
(3)A与Cl2混合光照可能发生爆炸,生成______(填化学式),A在该反应中作为______(填“氧化剂”或“还原剂”).
(4)溶液B中阴离子除OH-外还有______(填化学式),溶液D中存在的金属离子为______(填化学式).
参考答案:金属铁和金属铝的混合物中加入氢氧化钠后,会和金属铝发生反应生成偏铝酸钠和氢气,金属铁和氢氧化钠不反应,所以A是氢气,B是偏铝酸钠和过量的氢氧化钠的混合物,固体C是金属铁,金属铁可以和盐酸反应生成氯化亚铁和氢气,所以D是氯化亚铁.
(1)实现金属铁和偏铝酸钠、氢氧化钠混合物分离的方法是过滤,故答案为:过滤;
(2)气体A是氢气,故答案为:H2;
(3)氢气和氯气反应生成氯化氢,其中,氢元素的化合价升高,做还原剂,故答案为:HCl;还原剂;
(4)溶液B是偏铝酸钠和过量的氢氧化钠的混合物,铁可以和盐酸反应生成氯化亚铁和氢气,D是氯化亚铁,故答案为:AlO2-;Fe2+.
本题解析:
本题难度:一般
2、选择题 下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
参考答案:B
本题解析:A、氢气通过灼热的CuO粉末发生的反应为CuO+H2△Cu+H2O,固体由CuO变为Cu,反应后固体质量减小,错误;B、二氧化碳通过Na2O2粉末发生的反应为2Na2O2+2CO2====2Na2CO3+O2,固体由Na2O2变为Na2CO3,反应后固体质量增加,正确;C、铝与Fe2O3发生铝热反应,化学方程式为2Al+Fe2O3 Al2O3+2Fe,反应前后各物质均为固体,根据质量守恒定律知,反应后固体质量不变,错误;D、将锌粒投入Cu(NO3)2溶液发生的反应为Zn + Cu(NO3)2?="===" Zn(NO3)2+ Cu,固体由Zn变为Cu?,反应后固体质量减小,错误。
Al2O3+2Fe,反应前后各物质均为固体,根据质量守恒定律知,反应后固体质量不变,错误;D、将锌粒投入Cu(NO3)2溶液发生的反应为Zn + Cu(NO3)2?="===" Zn(NO3)2+ Cu,固体由Zn变为Cu?,反应后固体质量减小,错误。
本题难度:一般
3、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
[? ]
A.铝在空气中能很快形成氧化膜
B.铝箔表面温度低,未熔化
C.氧化铝的熔点比铝高
D.氧化铝薄膜包住了熔化的铝
参考答案:B
本题解析:
本题难度:一般
4、选择题 在测定硫酸铜晶体结晶水含量的实验中,叙述正确的是
A.铁架台、干燥管都是实验中必须使用的仪器
B.结晶水含量测定时称量次数不得少于四次
C.加热时坩埚中的药品刚变白就立即停止加热
D.加热后的药品应在空气中自然冷却后再称量
参考答案:B
本题解析:分析:A、根据实验所需仪器来回答;
B、实验成败的关键是保证结晶水全部失去;
C、在加热时,为了保证结晶水全部失去,要注意停止加热的时间;
D、在加热后冷却时,要防止硫酸铜吸水以得到纯净而干燥的无水硫酸铜.
解答:A、实验时,干锅放在三脚架的泥三角上来加热,所以无需铁架台,故A错误;
B、实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止,一般情况下,结晶水含量测定时称量次数不得少于四次,故B正确;
C、加热时,坩埚中的药品变白后再继续加热一会,保证结晶水全部失去,故C错误;
D、在加热后冷却时,为了防止硫酸铜吸水,应将硫酸铜放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸铜,故D错误.
故选B.
点评:本题考查了学生对化学实验的基本操作和常见仪器的使用,又考查了学生分析问题和解决问题的能力,从题目本身对学生的实验能力要求较高,但此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉、很简单.
本题难度:困难
5、选择题 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是
[? ]
①Al? ②NaHCO3? ③Al2O3? ④Mg(OH)2? ⑤Al(OH)3
A.①②③⑤
B.①④⑤
C.②③⑤
D.①③④
参考答案:C
本题解析:
本题难度:一般