1、选择题 通过一个阶段的复习,你认为下列说法正确的是
A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原
B.在原电池装置中,一定要有两个活泼性不同的金属作为电极材料
C.在化合物中,不是电解质就是非电解质
D.对于可逆反应,温度升高则该反应的平衡常数一定增大
参考答案:C
本题解析:A、在氧化还原反应中有一种元素即被氧化又被还原,错误;B、燃料电池中不需要,需要两个惰性电极,错误;C、化合物分为电解质和非电解质,正确;D、温度升高,平衡向吸热方向移动,平衡常数可能增大也可能减小,错误。
本题难度:一般
2、选择题 铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O = Fe(OH)2+ Ni(OH)2 下列有关该电池的说法不正确的是
[? ]
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e- = Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e- = Ni2O3+3H2O
参考答案:C
本题解析:
本题难度:一般
3、填空题 (4分)(1)已知:一定量CH4完全燃烧生成CO2和液态水时,放出热量QkJ;若将燃烧产物全部通入过量的澄清石灰水,可得到20g沉淀,请写出CH4燃烧的热化学方程式?
?
(2)请写出:氢氧燃料电池的正极电极反应式(电解质溶液为稀硫酸)?
参考答案:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l)? △H= -5QkJ/mol?(2分)
(2)O2+4H++4e-=2H2O?(2分)
本题解析:(1)20g沉淀是碳酸钙,物质的量是0.2mol,所以根据碳原子守恒可知燃烧生成的CO2也是0.2mol。所以生成1molCO2放出的热量是5QkJ,因此热化学方程式为
CH4(g)+2O2(g)=CO2(g)+2H2O(l)? △H= -5QkJ/mol。
(2)原电池正极是得到电子的,所以在氢氧燃料电池中氧气在正极通入,由于溶液显酸性,所以正极电极反应式为O2+4H++4e-=2H2O。
本题难度:一般
4、选择题 用惰性电极电解V L MSO4的水溶液,当阴极上有m g金属析出(阴极上无气体产生)时,阳极上产生x L气体(标准状况),同时溶液的pH由原来的6.5变为2.0(设电解前后溶液体积不变)。则M的相对原子质量的表示式为(? )
A.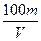
B.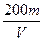
C.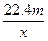
D.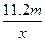
参考答案:BD
本题解析:4OH--4e-====2H2O+O2↑
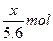 ?
?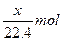
同时产生H+:n(H+)=".01V" mol
由得失电子守恒得:n(M)=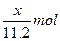 =
=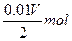
故:Mr=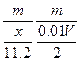
本题难度:简单
5、填空题 (8分)有人设计以铂和锌为电极材料,埋入人体作某种心脏病人的心脏起搏器的能源,它依靠人体血液中有一定浓度的O2和H2O进行工作。
(1)负极反应式是 。
(2)电池工作时,氧气在电极材料为 的电极上发生反应。
(3)电池总反应的化学方程式是 。
参考答案:(8分,方程式各3分) (1) Zn-2e-===Zn2+ (2) 铂片(3)2Zn+O2+2H2O==2Zn(OH)2
本题解析:考查原电池的有关判断及应用。
(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以负极是锌失去电子,电极反应式是Zn-2e-===Zn2+。
(2)氧气在正极通入,因此在铂片上发生还原反应。
(3)氧气的还原产物是OH-,所以总反应式是2Zn+O2+2H2O==2Zn(OH)2
本题难度:一般