1、填空题 (15分)甲醇(CH3OH)是一种可再生能,具有开发和应用的广阔前景,工业上一般可采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)t℃时,往1L密闭容器中充入1mol CO和2molH2。10min后,反应达到平衡,并测得CH3OH(g)的浓度为0.8 mol·L-1。
①该时间内反应速率v(H2) =____。t℃时,该反应的化学平衡常数K= (mol·L-1)-2
②下列各项中,能说明该反应已达到平衡的是_____________(填序号)
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,测得v正(CO) =v逆(CH3OH)
c.恒温、恒容条件下,容器内的气体密度不发生变化
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g)
(2)下图是该反应在T1 、T2温度下CO的转化率随时间变化的曲线。
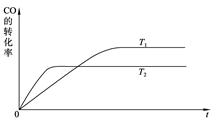
①该反应的焓变ΔH____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若保持容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=____________kJ·mol-1。
(4)我国在甲醇燃料电池技术方面已获得重大突破。甲醇燃料电池的工作原理如图所示。
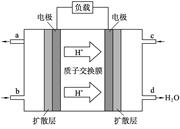
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为 。
参考答案:(1)①0.16 mol·L·min-1 (2分) 25 (mol·L-1)-2(2分)
②ab(2分,缺1项扣1分,有错项0分)
(2)①<(1分)②>(1分)③b(2分)
(3)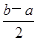 (2分)
(2分)
(4)①CH3OH(1分)②O2 + 4e-+ 4H+ = 2H2O(2分)
本题解析:(1)①
所以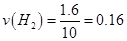 mol·L·min-1;
mol·L·min-1;
化学平衡常数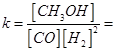 25 (mol·L-1)-2;②该反应为体积可变的反应,所以恒温、恒容条件下,容器内的压强不发生变化,反应达到平衡状态;v正(CO) =v逆(CH3OH),正逆反应速率相等,达到平衡状态;恒温、恒容条件下,
25 (mol·L-1)-2;②该反应为体积可变的反应,所以恒温、恒容条件下,容器内的压强不发生变化,反应达到平衡状态;v正(CO) =v逆(CH3OH),正逆反应速率相等,达到平衡状态;恒温、恒容条件下,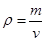 ,V不变,m不所以密度始终不变,变容器内的气体密度不发生变化,不一定平衡;单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g),无法判断逆反应的速度,所以不一定平衡;
,V不变,m不所以密度始终不变,变容器内的气体密度不发生变化,不一定平衡;单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g),无法判断逆反应的速度,所以不一定平衡;
(2)①根据图像,先拐先平,所以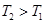 ,即升高温度CO的转化率减小,平衡左移,所以ΔH<0;②
,即升高温度CO的转化率减小,平衡左移,所以ΔH<0;②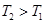 升高温度,平衡左移,所以升高温度平衡常数减小;③升高温度平衡左移,甲醇产率降低;将CH3OH(g)从体系中分离,平衡右移,甲醇产率增大;使用合适的催化剂,平衡不移动,甲醇产率不变;充入He,使体系总压强增大,平衡不移动,甲醇产率不变。
升高温度,平衡左移,所以升高温度平衡常数减小;③升高温度平衡左移,甲醇产率降低;将CH3OH(g)从体系中分离,平衡右移,甲醇产率增大;使用合适的催化剂,平衡不移动,甲醇产率不变;充入He,使体系总压强增大,平衡不移动,甲醇产率不变。
(3)根据盖斯定律CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=(①—②)÷2=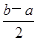 kJ·mol-1;
kJ·mol-1;
(4)根据电池内H+右移,所以左侧为负极发生氧化反应,b孔通入CH3OH;正极通入氧气,正极反应式为O2 + 4e-+ 4H+ = 2H2O 。
考点:本题考查平衡移动、平衡常数、燃料电池。
本题难度:困难
2、选择题 把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两连接,可组成若干原电池。若?a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极。则下列说法正确的是
A.b的活动性一定在氢之后
B.若a与b相连,则a为原电池的正极
C.若c与b相连,则b极上发生氧化反应
D.若将稀H2SO4换为NaOH溶液,a、c分别为镁、铝,则a极上有气泡产生
参考答案:D
本题解析:
本题难度:一般
3、选择题 结合图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
参考答案:A、题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;故A对;
B、I中的负极反应式为:Zn-2e-=Zn2+,而II中负极是铁,反应式为:Fe-2e-=Fe2+,故B错;
C、I溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而II溶液显酸性,电极反应式为:2H++2e-=H2↑,故C错;
D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错;
故选A.
本题解析:
本题难度:简单
4、选择题 在右图所示的原电池中,下列说法正确的是
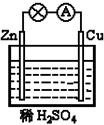
A.负极发生还原反应
B.正极反应为 Cu - 2e- Cu2+
Cu2+
C.电子由锌片通过导线流向铜片
D.该装置能将电能转化为化学能
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,产生氢气,答案选C。
本题难度:简单
5、选择题 化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是(? )
参考答案:A
本题解析:A:合成氨过程中,正反应速率逐渐减小,逆反应速率由0逐渐增大,平衡时,由不同物质表示正逆反应速率时,数值上符合系数比,正确
B:通入氨气生成醋酸铵强电解质,溶液导电性增强,不正确
C:随着碳的时的增加,依次发生反应:C+O2=CO2? CO2+C=2CO,可见当碳小于1mol时,产物为CO2,当大于1mol后,CO2的量逐渐减小到0,而CO的量由0逐渐增大到2mol,不正确
D:由于发生:Ca2++HCO3-+OH-=CaCO3↓+H2O,故一开始就有沉淀生成,不正确
答案为A
本题难度:一般