1、填空题 硫酸铅(PbSO4)广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO4的流程如下:
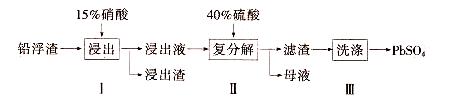
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9x10-5,Ksp(PbSO4)=1.6xl0-8。
(1)已知步骤I有NO气体产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的化学方程式?。
(2)步骤I需控制硝酸的用量并使Pb稍有剩佘,目的是?。
(3)母液可循环利用于步骤I,其溶质主要是?(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是?。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去?。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为?。
2、填空题 (14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是?。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为:?。
②精确研究表明,B?-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:??、
?;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为:?。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极?、负极?。
3、选择题 水泥是一种重要的建筑材料.下列有关水泥的说法中不正确的是( )
A.水泥具有水硬性
B.水泥是一种纯净物
C.水泥是水下工程必不可少的材料
D.水泥、沙子和水的混合物叫混凝土
4、实验题 现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
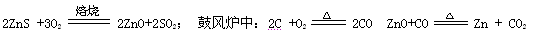
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
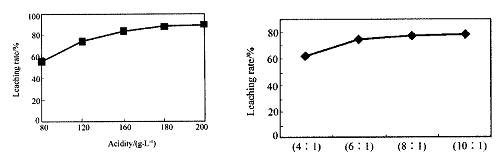
图1酸度对铟浸出率的影响?图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为?。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气?。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式?
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
5、选择题 具有暂时硬度的水经长时间煮沸后,水的硬度就可降低,这是因为钙与镁的酸式盐已转化为…( )
A.CaCO3、MgCO3
B.Mg(OH)2、Ca(OH)2
C.Ca(OH)2、MgCO3
D.CaCO3、Mg(OH)2