1、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
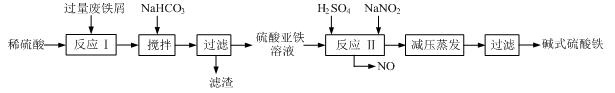
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)加入过量废铁屑的目的是?,此时溶液中存在的阳离子主要有?,用NaHCO3调整溶液pH时的离子方程式是?。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是?。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式?。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产?吨碱式硫酸铁。
2、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是? ( )。
A.Na,Ba,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
3、选择题 海水中含有氯化镁,是镁的主要来源之一。从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将得到的产物熔融后电解。关于提取镁,下列说法正确的是? ( )。
A.此法对环境不会造成任何污染
B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化
C.若提取12 kg Mg,则电子转移1 000 mol
D.以上提取镁的过程涉及的离子反应共有3个
4、填空题 (14分)无水AlCl3易升华,可用作有机合成的催化剂等。工业 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
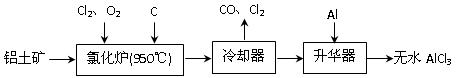
(1)氯化炉中Al2O3、C12和C反应的化学方程式为?▲?。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为?▲ ?。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是?▲?。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3) 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式? ▲?、? ▲?。
②AlCl3产品的纯度为?▲ ?。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是? ▲?。
5、填空题 材料是人类赖以生存的物质基础。请回答:
(1)为防止钢壳船体发生电化学腐蚀,可在船身装上一定数量的____。
A.锌块
B.铜块
(2)聚乙烯塑料可回收利用,是因为它具有___。
A.热塑性
B.热固性
(3)玻璃可被吹制成各种形状的制品,是因为玻璃____,能够在一定温度范围内软化。
A.有固定的熔点
B.无固定的熔点