1、选择题 从化学原理和经济利益角度分析,下列从海水中提取镁单质的方法最可行的是
A.海水
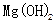

B.海水
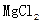
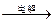

C.海水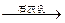
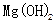
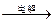

D.海水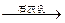
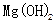
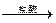
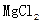

2、填空题 下图是某工厂对海水资源进行综合利用的示意图。

请回答下列问题:
(1)请列举一种海水淡化的方法 。?
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 。?
(3)侯氏制碱法中向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入 (填化学式),理由是 。再由NaHCO3制得纯碱,化学方程式为 。?
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取。已知有关物质的熔沸点数据如下:
?
| MgO
| MgCl2
|
熔点/℃
| 2 852
| 714
|
沸点/℃
| 3 600
| 1 412
|
?
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 。?
3、选择题 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )。
A.加热Al2O3
B.加热HgO
C.电解熔融NaCl
D.铝粉和Fe2O3共热
4、选择题 下列说法不正确的是( )
A.玻璃工业不涉及氧化还原反应
B.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐
C.一般合金的硬度比各成分金属要大,多数合金的熔点也比成分金属要低
D.有氧气参加的任何发光、发热的剧烈的化学反应才能称之为燃烧
5、填空题 (12分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
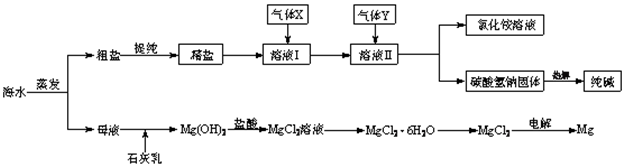
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ;⑥加适量的盐酸;⑦ 。
(2)溶液Ⅱ中发生反应的化学方程式是: 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用___ ___ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式________ __ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:_____?_______。