1、选择题 等物质的量的SO2和Cl2混合后,缓慢通入Ba(NO3)2溶液 ,再滴入品红试液,应发生的现象是
,再滴入品红试液,应发生的现象是
A?无沉淀生成,溶液显红色? B?无沉淀生成,溶液显无色
C?有沉淀生成,溶液显无色? D?有沉淀生成,溶液显红色
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列关于浓硫酸和稀硫酸的叙述中正确的是
A.都能作干燥剂
B.加热时都能与铜发生反应
C.都具有一定的氧化性
D.在常温下都能用铁制容器贮存
参考答案:C
本题解析:稀硫酸不能作为干燥剂,A错误;稀硫酸和铜不反应,B错误;浓硫酸表现氧化性是酸根体现的,稀硫酸表现氧化性是氢离子表现的,C正确;稀硫酸在常温下和铁反应,不能用铁制容器贮存,D不正确,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,主要是考查学生对硫酸性质的了解掌握程度,难度不大。该题的关键是记住稀硫酸和浓硫酸性质,然后灵活运用即可。
本题难度:简单
3、选择题 下列实验报告记录的实验现象正确的是(?)
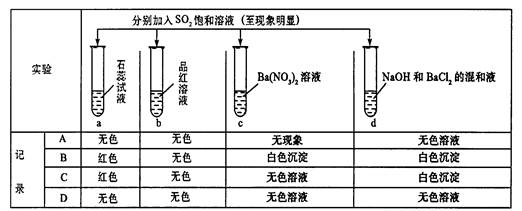
参考答案:B
本题解析:a试管中:SO2通入石蕊溶液中,因SO2不能使酚酞和石蕊褪色。所以应考虑SO2在水中生成H2SO3使得溶液显酸性,石蕊遇酸变红。b试管中:SO2可是品红溶液褪色,所以SO2通入品红变为无色溶液。c试管中:SO2具有还原性,在酸性条件下Ba(NO3)2溶液中的NO3-具有氧化性,可将SO2氧化成SO42-,最终生成BaSO4白色沉淀。d试管中:SO2与NaOH反应会生成Na2SO3和水。而SO32-与Ba2+反应生成BaSO3白色沉淀。2的化学性质:酸性氧化物,漂白性,还原性。
本题难度:一般
4、选择题 用右图所示装置进行实验,下列对实验现象的解释不合理的是

?
| ①中试剂
| ①中现象
| 解?释
|
A
| Ba(NO3)2溶液
| 生成白色沉淀
| SO32-与Ba2+生成白色BaSO3沉淀
|
B
| 品红溶液
| 溶液褪色
| SO2具有漂白性
|
C
| 紫色石蕊溶液
| 溶液变红
| SO2与水反应生成酸
|
D
| 酸性KMnO4溶液
| 紫色褪去
| SO2具有还原性
|
?
参考答案:A
本题解析:A.Cu与浓硫酸发生反应产生SO2气体,将SO2气体通入到Ba(NO3)2溶液由于硝酸有强的氧化性,会把BaSO3氧化成BaSO4沉淀。错误。其它选项的试剂、现象及原因都正确。2气体的制备及化学性质的知识。
本题难度:一般
5、选择题 在Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中通入适量H2S,产生的沉淀物是
A.FeS和CuS
B.CuS
C.CuS和S
D.Al2S3、FeS和CuS
参考答案:C
本题解析:Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中氧化性离子的强弱顺序为Fe3+>Cu2+>Al3+,其中铁离子氧化H2S生成单质S沉淀,铜离子和硫离子反应生成硫化铜沉淀,铝离子和H2S不反应,有关反应的离子方程式是2Fe3++H2S=S+2H++2Fe2+、Cu2++H2S=CuS↓+2H+,所以最后生成的沉淀为CuS和S,答案选C。2S与硫酸盐反应产物的有关判断
本题难度:一般