| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《硫及其化合物》高频考点预测(2017年最新版)(六)
参考答案:(1)夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分液漏斗旋塞,若漏斗中水滴入部分后便停止,证明气密性好。若水一直滴入,则气密性不好。 本题解析:(1)检查A装置的气密性的方法是夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分液漏斗旋塞,若漏斗中水滴入部分后便停止,证明气密性好。若水一直滴入,则气密性不好。(2)在装置A浓 与Cu发生反应,化学方程式为H2SO4(浓)+Cu 本题难度:一般 3、判断题 酸雨主要是大量燃烧含硫燃料释放出SO2所造成的,试回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)_______________。 ②如果将刚取样的上述雨水和自来水相混合,pH将变______,原因是(用化学方程式表示)___________________。 (2)你认为减少酸雨产生的途径可采用的措施是______________。 ①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源 A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤ |
参考答案:(1)①SO2+H2O H2SO3,2H2SO3+O2=2H2SO4.②小 H2SO3+HClO=H2SO4+HCl(或SO2+2H2O+Cl2=H2SO4+2HCl) (2)C(3)不可取.因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害.
H2SO3,2H2SO3+O2=2H2SO4.②小 H2SO3+HClO=H2SO4+HCl(或SO2+2H2O+Cl2=H2SO4+2HCl) (2)C(3)不可取.因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害.
本题解析:(1)酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致.雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应.
(2)减少酸雨的形成须减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
(3)将烟囱建高,并没有减少SO2的排放,只是将SO2在地表的含量降了下来,无疑将增加高空中SO2的浓度,酸雨依旧会形成.
本题难度:简单
4、选择题 有Na2S、Na2SO3和Na2SO4的混合物,经测定此混合物中硫的质量分数为32.0%。则此混合物中氧的质量分数为
A.36.8%
B.37.6%
C.22.0%
D.无法计算
参考答案:C
本题解析:略
本题难度:简单
5、实验题 某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。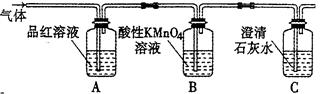
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是?(填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是?g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是?(填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是?g,标况下产生SO2的体积为______________L。
(2)A装置中品红溶液颜色?(填“褪色”或“不褪色”),证明含有?气体。
(3)实验过程中,装置C将观察到的现象是_______________________________。
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接右图中?装置,以确认SO2是否除尽。
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨?B.破坏臭氧层? C.温室效应
参考答案:(14分)
(1)氧化剂(1分)? 39.2 (2分)? 8.96(2分)
(2)褪色(1分)? SO2(或二氧化硫)(2分)
(3)石灰水变浑浊(2分)
(4)a (2分)
(5)A? C (每空1分,共2分)
本题解析:(1)浓H2 SO4中硫化合价降低,作氧化剂,0.2mol碳的完全反应,则消耗H2S04的质量是0.4mol×98g/mol=39.2g;标况下产生SO2的体积为0.4mol×22.4L/mol=8.96?L,答案:氧化剂(1分)? 39.2 (2分)? 8.96(2分)
(2)A装置中品红溶液颜色褪色,说明有SO2中生成。答案:褪色(1分), SO2(或二氧化硫)(2分)
(3)B将SO2除去后,装置C将观察到的现象石灰水变浑浊,说明有CO2生成,答案:石灰水变浑浊(2分)
(4)应该在B、C装置之间连接a装置,用来证明SO2已经除尽,答案:a (2分)
(5)SO2主要是形成酸雨,CO2主要是形成温室效应,答案:A? C (每空1分,共2分)
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《与量有关的.. | |