1、填空题 A、B、C、D、E五种短周期元素的原子序数依次增大,且知:
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D2C2的电子式__________________。
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生__ _______mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
参考答案:(1)>
(2)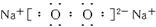
(3)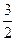 ? 2Al+2OH-+2H2O====2
? 2Al+2OH-+2H2O====2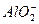 +3H2↑
+3H2↑
(4)H++OH-====H2O
Al(OH)3+3H+====Al3++3H2O
Al(OH)3+OH-====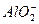 +2H2O
+2H2O
(5)4NH3+6NO?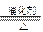 5N2+6H2O
5N2+6H2O
本题解析:本题考查元素及其化合物的有关性质,考查知识的综合运用能力。由题意A、D同主族,A的原子序数及原子半径最小,D的原子半径最大,可知:A为H,D为Na;所得的盐中均含有C元素,可知C元素为氧元素;由(4)可知B为N, E为Al。NaH与水反应生成NaOH和H2,溶液显碱性。Na2O2是含有过氧键的离子化合物,HNO3、NaOH、Al(OH)3三者之间两两反应,体现了酸碱中和和Al(OH)3的两性。NH3和NO催化反应生成N2和水。
本题难度:简单
2、填空题 (已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。?
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
参考答案:(1) ①FeCl3?(2分)? 2Cl-+2H2O 2OH-+Cl2↑+H2↑(2分)
2OH-+Cl2↑+H2↑(2分)
②2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分)? Fe+2Fe3+=3Fe2+? (2分)?盐酸(2分)
(2)HNO3(2分,只要符合题意都给分)
(3)Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O (2分)
(4)CO2?SO2?品红溶液、溴水或酸性高锰酸钾溶液等(共3分,每空1分。只要符合题意都给分)
本题解析:(1)根据D是生产、生活中用量最大、用途最广的金属单质可判断D为Fe。
①若A可用于自来水消毒,则A为Cl2。氯气与铁反应生成氯化铁,则B是氯化铁。工业上通过电解饱和食盐水制备氯气,所以工业上制取A的离子方程式为2Cl-+2H2O 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。
②用氯气制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯化铁与铁反应生成氯化亚铁,则C为FeCl2,所以反应②的离子方程式为Fe+2Fe3+=3Fe2+。亚铁离子易水解,因此配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解。
(2)若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,因此可判断为HNO3。
(3)若D是氯碱工业的主要产品之一,B有两性,所以B为两性氢氧化物为Al(OH)3,因此D是氢氧化钠,所以能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,则反应②的离子方程式是Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O。
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2。SO2具有漂白性和还原性,因此可以用品红溶液、溴水或酸性高锰酸钾溶液等鉴别。
本题难度:一般
3、填空题 (14分)下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)
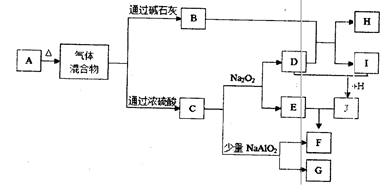
(1)若A加热后得到等物质的量的B和C,则A的化学式为?。
(2)实验室检验B的方法是?。
(3)写出上述由I生成J的化学方程式?。
(4)写出C和少量NaAlO2溶液反应的离子方程式?。
(5)由H所含的两种元素组成的18电子微粒的电子式为?。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择?(填代号);
A.石灰石?B.稀HNO3?C.稀H2SO4?D.稀HCl? E.纯碱
所需气体发生装置是?(填代号);所选装置中涉及到的玻璃仪器的名称为?。
参考答案:

本题解析:略
本题难度:一般
4、填空题 (6分)下图所示各物质是由短周期部分元素组成的单质或化合物,图中部分反应条件及物质未列出。已知:A、C、D、F、K均为单质;C、E、F、G、K常温下是气体且K为黄绿色气体;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液;B、G可以使湿润的红色石蕊试纸变蓝;反应④是化肥制造业的重要反应。
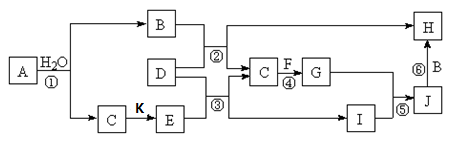
请回答下列问题:
(1)G的电子式为_______________。
(2)J的化学式为_______________。
(3)写出反应②的离子方程式:______________?。
(4)写出反应④的化学方程式:______________?。
参考答案:(1)?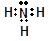 ?(1分)?(2) Al(OH)3(1分)
?(1分)?(2) Al(OH)3(1分)
(3)2Al + 2H2O + 2OH-= 2AlO2-+3 H2↑(2分)
(4)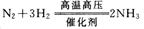 (2分)
(2分)
本题解析:K为黄绿色气体,为Cl2。B、G可以使湿润的红色石蕊试纸变蓝,B、G为碱性物质,G常温下是气体,高中的碱性气体只有NH3,J为溶于碱的白色沉淀,是Al(OH)3。根据C气体单质与F气体单质反应生成氨气,且A与水反应生成碱性物质B和气体单质C,则C为H2,F为N2.A为Na, B为NaOH。则H为NaAlO2,则D单质为Al,E为HCl,I为AlCl3
本题难度:一般
5、填空题 (14分)下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):
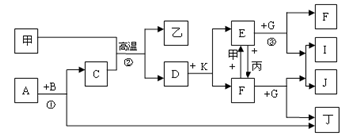
(1)写出乙的化学式?、A的电子式?、甲在周期表中位置是?;
(2)写出G的一种用途?;
(3)写出B与K反应的化学方程式:?;
(4)整个转换过程中属于氧化还原反应的有?个;
(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式?。
参考答案:

本题解析:略
本题难度:简单