1、推断题 已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。?

(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式________________________;反应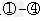 中属于非氧化还原反应的是_________?;
中属于非氧化还原反应的是_________?;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极_______________________ 阳极____________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式______________________
参考答案:(1)?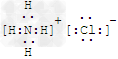 ?;?KSCN?
?;?KSCN?
(2)3Fe2+ +NO3-+4H+=?3Fe3+ +NO↑+2H2O?
(3)4NH3+3O2=2N2+6H2O?;①④?
(4)阴极:Fe3+ +e-=?Fe2+?;?阳极:2Cl-?-?2e-=?Cl2?↑?
(5)(NH4)?2Fe(C2O4)2=FeO+2CO↑+2CO2↑+2H2O+2NH3?↑
本题解析:
本题难度:一般
2、推断题 (7分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
ABCD
请回答下列问题:
(1)若常温下A为淡黄色固体单质,D为强酸,则A、D分别为(填写化学式)A:________,D:________。
写出D→B的化学方程式:____________________________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则A为______________,写出A→B转化的化学方程式:________________________________________________。
参考答案:(1)S? H2SO4?Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)NH3? 4NH3+5O2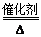 4NO+6H2
4NO+6H2
本题解析:(1)常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸.由硫酸制得二氧化硫,则可以由浓硫酸与铜反应,即
反应为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,故答案为:S;H2SO4;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:S;H2SO4;Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是氨气,则B是一氧化氮,C是二氧化氮,D是硝酸.由氨气制得一氧化氮,是氨气的催化氧化,即4NH3+5O2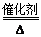 =4NO+6H2O。
=4NO+6H2O。
点评:题把S和氨气以及硫酸、硝酸的制取结合起来,引导学生对S、N两种元素及其化合物的性质进行总结,它启发我们,学习时要善于总结,形成比较系统的知识结构.
本题难度:一般
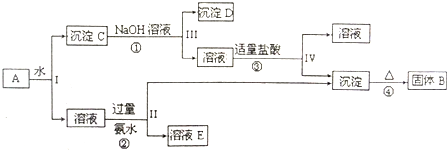
3、简答题 某混合物A,含有Al2(SO4)3、Al2O3、和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是______.
(2)根据上述框图反应关系,写出B、E所含物质的化学式B______;溶液E______.
(3)写出反应①、②、③的离子方程式
①______
②______
③______.
参考答案:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液是硫酸铝溶液,沉淀C是氧化铝和氧化铁,将沉淀C溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀D是氧化铁,溶液是偏铝酸钠溶液,向偏铝酸钠溶液加入适量盐酸,得到的沉淀是氢氧化铝,溶液是氯化钠溶液,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,所以溶液E是硫酸铵.
(1)分离溶液和固体的操作是过滤;
故答案为:过滤;
(2)通过以上分析知,B是Al2O3,E是(NH4)2SO4;
故答案为:Al2O3,(NH4)2SO4;
(3)①氧化铝和氢氧化钠、水反应生成四羟基合铝酸钠,离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-;
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
②硫酸铝和氨水反应生成氢氧化铝和硫酸铵,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
③四羟基合铝酸钠和盐酸反应生成氢氧化铝和水,离子方程式为[Al(OH)4]-+H+=Al(OH)3↓+H2O;
故答案为:[Al(OH)4]-+H+=Al(OH)3↓+H2O.
本题解析:
本题难度:一般
4、简答题 中学常见反应的化学方程式是A+B----->X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的化学式是______.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为浓硫酸,则化学方程式为:______,则反应中氧化剂与还原剂的物质的量之比是______.
(3)若A为金属单质,常温下A在B的浓溶液中发生“钝化”,且A为短周期元素,且A可溶于NaOH溶液中.A元素为______(填化学式),其所在周期表中的位置为:
______(填所在周期和族);A与NaOH反应的离子方程式是______.
参考答案:(1)A+B----->X+Y+H2O,A、B的物质的量之比为1:4,若Y是黄绿色气体为Cl2,故答案为:Cl2
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,判断为碳,碳和浓硫酸反应的化学方程式为:C+2H2SO4?加热?.?CO2↑+2SO2↑+2H2O;反应中氧化剂与还原剂的物质的量之比为2:1;
故答案为:C+2H2SO4?加热?.?CO2↑+2SO2↑+2H2O;2:1;
(3)若A为金属单质,为短周期元素,且A可溶于NaOH溶液中,说明A为Al,Al在周期表中的位置为:第三周期 ?IIIA族、铝和氢氧化钠溶液反应的化学方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:第三周期 IIIA族;2Al+2OH-+2H2O═2AlO2-+3H2↑;
本题解析:
本题难度:一般
5、填空题 硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢:
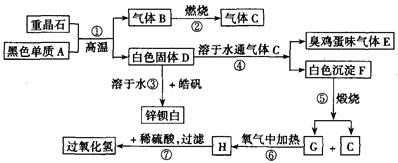
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
参考答案:
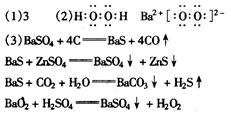
本题解析:
重晶石是BaSO4,黑色单质A通常是碳。由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2。有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-。BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS。BaS溶于H2O,与皓矾(ZnSO4·7H2O)反应生成锌钡白(BaSO4和BaS的混合物)。BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3。进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2。
本题难度:一般